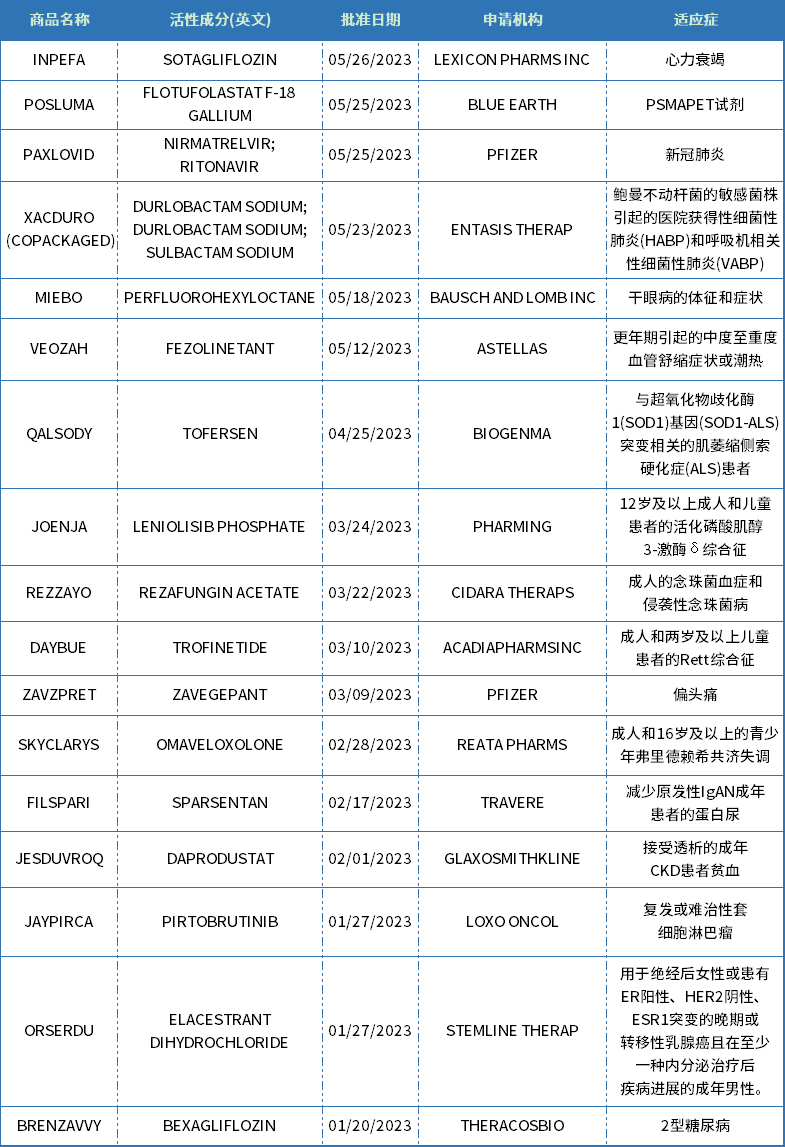
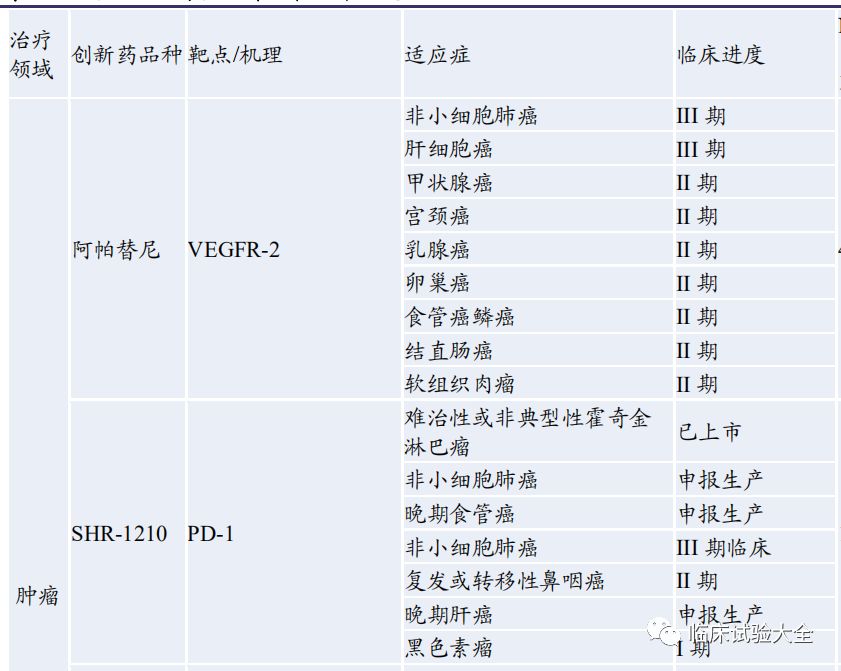
2023上半年,美国FDA批准了26款新分子实体上市
2023年,新药上市很抢眼,仅上半年美国FDA已批准26款新分子实体,此外还批准了多款细胞与基因疗法。截至7月1日,2023年美国药品审评中心(CDER)总计批准57项NDA申请和8项BLA申请,其中
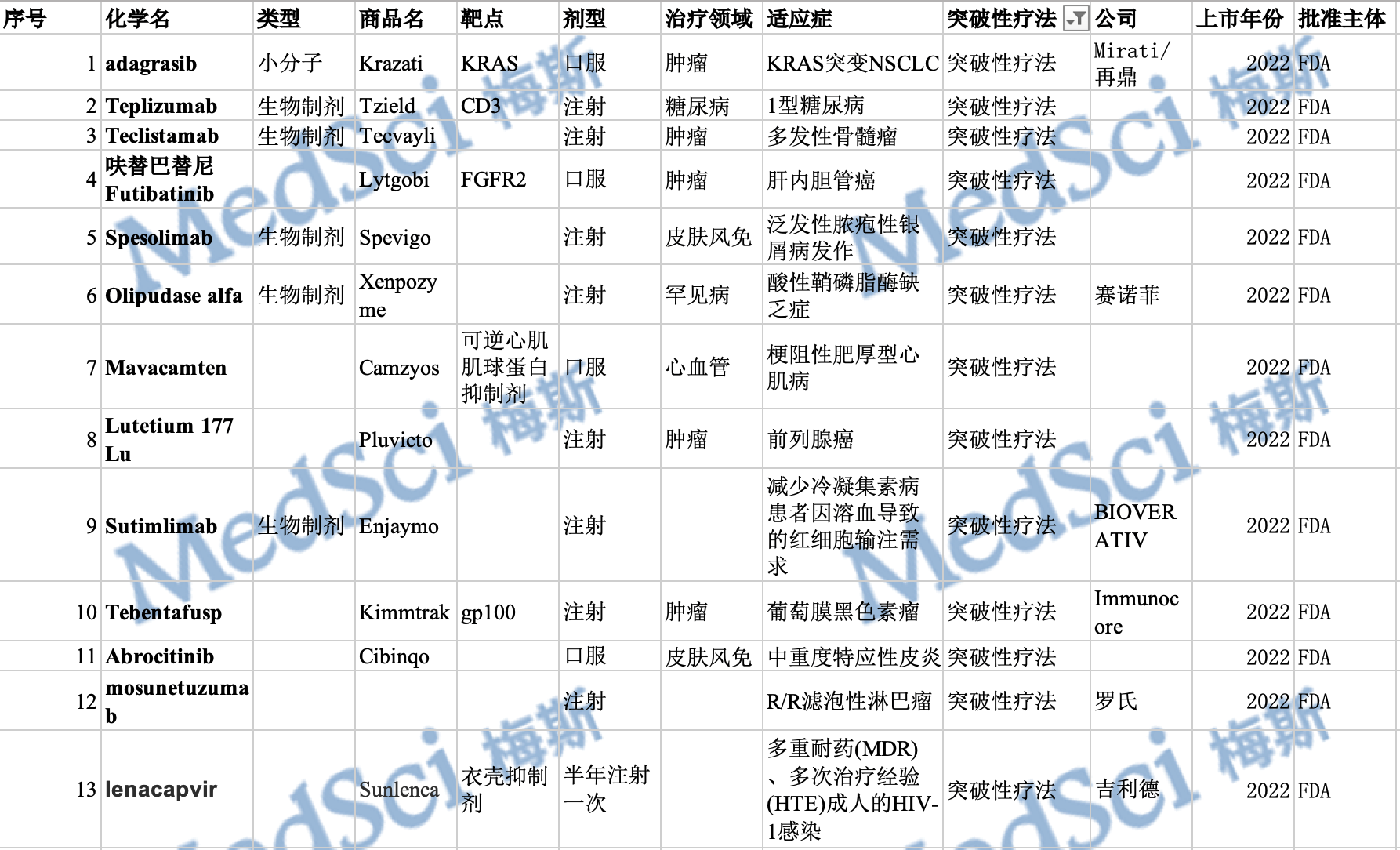
梅斯盘点:FDA在2022年度批准的创新药(上)
2022年即将结束,截至今年12月30日,美国FDA的药物评估和研究中心(CDER)已经批准了37款创新药。FDA的生物制品评估和研究中心(CBER)也批准了至少15项生物制品许可申请(BLA)。虽然
梅斯盘点:FDA在2022年度批准的创新药(下)
截至2022年12月30日,美国FDA的药物评估和研究中心(CDER)已经批准了37款创新药。FDA的生物制品评估和研究中心(CBER)也批准了至少15项生物制品许可申请(BLA)。虽然与往年相比,今
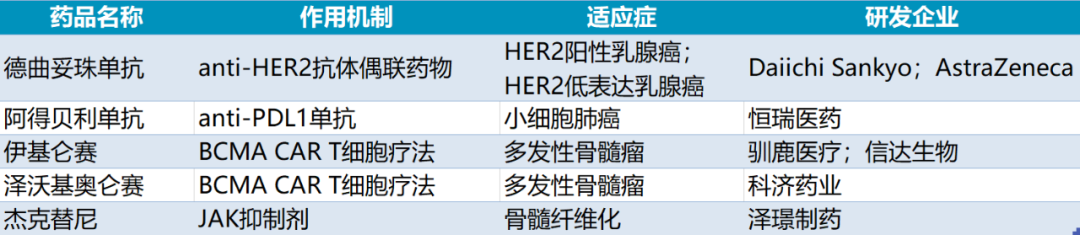
2023年有望在国内上市的重磅创新药
2022年,NMPA批准42种创新药物(包括中药和新适应症),较2021年有所下降。但是也有很多重磅药物批准,让大量患者受益。2023年,哪些药物会在国内批准上市呢?
Nature发布CDE团队文章:中国创新药的发展趋势
过去十年间,由于监管改革以及政策变化,中国创新药的临床开发和监管审查过程发生了巨大的变化。这些改革以及新政策出台旨在鼓励创新药的开发,特别是针对罕见、严重或危及生命的疾病,确保相应患者能及时获得药物治
创新药人体生物利用度和生物等效性研究技术指导原则(征求意见稿)
为进一步鼓励和引导科学合理地开展创新药人体生物利用度和生物等效性研究,我中心组织起草了《创新药人体生物利用度和生物等效性研究技术指导原则(征求意见稿)》,现在中心网站予以公示,以广泛听取各界意见和建议
化学药品创新药上市申请前会议药学共性问题相关技术要求(征求意见稿)
为鼓励创新药研发和申报,提高申请人和监管机构沟通交流的质量与效率,加快创新药上市进程,我中心组织制订了《化学药品创新药上市申请前会议药学共性问题相关技术要求(征求意见稿)》。
罕见病创新药维万心®开出华东地区首张处方
今日(12月8日),近期在国内获批上市的罕见病创新药物维万心?(氯苯唑酸软胶囊,Vyndamax?,61mg)在上海交通大学医学院附属瑞金医院开出了华东地区首张处方。维万心是全球首个、也是唯一经批准治
中国创新药如何才能在美国取得商业成功
泽布替尼开创了中国原创新药境外上市的先河。随着国际化的理念日益深入人心,中国药企在海外加速开展越来越多的临床试验,相信在不远的将来,中国创新药在海外将进入收获期。
荣昌生物招股获19家机构热捧!两款创新药物上市在即
10月28日,已通过港交所聆讯的荣昌生物制药(烟台)股份有限公司(以下简称「荣昌生物」)启动公开招股,拟全球发行7653.7万股H股,发行价区间为50.30至52.10港元,股票代码为9995.HK。
药品上市许可人制度助力阿尔茨海默病创新药获批
在上海率先试点的药品上市许可持有人制度,助推创新药物上市过程。2日,国家药品监督管理局官网发布消息,治疗阿尔茨海默病原创新药——甘露特钠获批上市。记者从上海市药品监督管理局获悉,这是新制度试点以来,推动创新研发成果快速上市的成功案例之一。阿尔茨海默病是神经退行性脑部疾病,目前全球患者高达5000万人,中国患者约占20%,其治疗仍是世界难题。甘露特钠由中国海洋大学、中科院上海药物研究所和上海绿谷制药