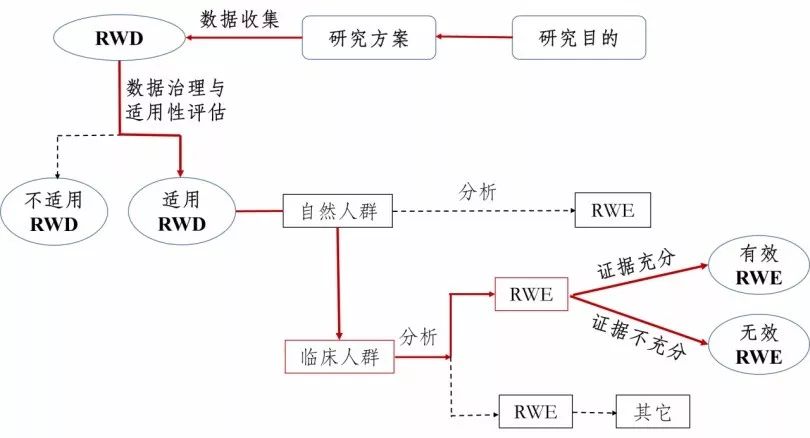
真实世界证据支持药物研发审评,这四点思考值得关注!
1月7日,国家药监局把2020年的一号文件,留给了此前就备受行业关注的真实世界证据支持药物研发与审评。 在其官网上,药监局同时公布了《真实世界证据支持药物研发与审评指导原则(试行)》,以及该文件的起草说明。作为国内发布的首个真实世界证据支持药物研发与审评的指导文件,这被视为新药研发审评道路上的里程碑事件,并迅速引起了行业的密切关注。事实上,如何利用真实世界证据评价药物的有效性和安全性
E药经理人 - 真实世界,证据 - 2020-01-11
CDE发布《真实世界证据支持药物研发的基本考虑》意见稿
5月29日,动脉新医药获悉,国家药品监督管理局药品审评中心组织起草发布了《真实世界证据支持药物研发的基本考虑(征求意见稿)》。为鼓励研究和创制新药的要求,考虑到药物临床研发过程中,存在临床试验不可行或难以实施等情形,利用真实世界证据用以评价药物的有效性和安全性成为可能的一种策略和路径。
动脉网 - CDE,药物研发,罕见病 - 2019-05-30
医疗器械境外临床试验数据怎么用?
1月11日,CFDA发布了《接受医疗器械境外临床试验数据技术指导原则》,对使用境外临床试验数据加速医疗器械国内上市做了更细致的规定。
健康点healthpoint - 医疗器械,境外临床试验数据 - 2018-01-12
最新!国家药监局发文 中药发展机会来了
5月29日,国家药监局药品审评中心发布《关于公开征求意见的通知》。这是真实世界证据如何用于药物研发,首次在官方文件中提出。 ▍什么是真实世界研究?“真实世界研究”这个名词在近年来在医药领域的曝光率越来越高,究竟什么是真实世界研究? 简单来说,真实世界研究(
赛柏蓝 - 国家药监局,中药,发展 - 2019-05-31
“中药审批免临床试验”系误读
近日,国家食品药品监督管理总局公布《中药经典名方复方制剂简化注册审批管理规定(征求意见稿)》,提出符合相关要求的经典名方制剂申报生产,可免报临床试验资料。对此有观点认为这是有意降低中药上市准入门槛,甚至抛弃药品上市基本原则。著名学术杂志《自然》也在其网站刊发记者文章对产品安全性表示担忧。事实果真如此吗?记者为此采访了多位业内权威专家。
健康报 - 中药审批,临床试验 - 2017-12-23
关于公开征求《小儿便秘中药新药临床研发技术指导原则》意见的通知
为丰富完善中医药理论、人用经验和临床试验相结合的中药注册审评证据体系,药审中心起草了《小儿便秘中药新药临床研发技术指导原则(征求意见稿)》。
国家药品监督管理局药品审评中心 - 小儿便秘中药新药 - 2023-10-25
关于公开征求《中药新药用于紧张型头痛的临床疗效评价技术指导原则(征求意见稿)》意见的通知
药审中心起草了《中药新药用于紧张型头痛的临床疗效评价技术指导原则(征求意见稿)》,经中心内部讨论并组织专家研讨,已形成征求意见稿。
国家药品监督管理局药品审评中心 - 紧张型头痛 - 2023-09-28
医药专家:所有创新药进医保“不现实”,商保要担起责任
10月初,中央办办公厅、国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(以下简称“创新意见”)。为确保《创新意见》各项改革措施尽快顺利实施,国家食药监总局(CFDA)形成《药品管理法修正案》(草案征求意见稿)(以下简称“药品管理法征求意见稿”),并在10月23日公开征求意见。征求意见相关反馈信息提交截止日期为10月30日。
健康点healthpoint - 创新药,医保,商保 - 2017-10-30
关于公开征求《呼吸道合胞病毒感染药物临床试验技术指导原则》意见的通知
呼吸道合胞病毒是世界范围内引起5岁以下儿童急性下呼吸道感染最常见的病毒病原,是造成婴幼儿病毒性呼吸道感染住院的首要因素。国内多家制药企业已开始呼吸道合胞病毒感染药物的研发。目前国内外尚参考的指导原则,
国家药品监督管理局药品审评中心 - 药物临床试验,呼吸道合胞病毒感染 - 2022-08-19
对比药品关联审评审批政策 明确法规趋向
2019年7月16日,国家药监局发布《关于进一步完善药品关联审评审批和监管工作有关事宜的公告》(2019年 第56号,简称"正式稿",下同),这对应的是2019年4月4日发布的国家药监局综合司再次公开征求《关于进一步完善药品关联审评审批和监管工作有关事宜的公告(征求意见稿)》(简称"征求意见稿",下同)。通过比较两者,可以明确政策法规的趋向。
CPhI制药在线 - 药品关联审批,法规政策 - 2019-07-31
中国拟有条件接受境外临床试验数据,新药上市不再“慢半拍”
10月20日,国家食药监总局药审中心发布关于《接受境外临床试验数据的技术要求》征求意见稿(下称“征求意见稿”),称将有条件接受境外临床试验数据。
澎湃新闻 - 境外临床实验数据,药品注册,国家食药监总局 - 2017-10-24
CDE发布《中药生物效应检测研究技术指导原则(征求意见稿)》
为提高中药质量可控性,鼓励研究探索中药生物效应检测方法,建立完善符合中药特点且关联临床疗效和安全性的质量评价与控制体系,我中心组织起草了《中药生物效应检测研究技术指导原则(征求意见稿)》。
CDE - CDE,指导原则,中药生物 - 2020-10-02
真实世界证据支持药物研发的基本考虑
为落实国务院《关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)以及中共中央办公厅、国务院办公厅印发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号)鼓
CDE - 指导原则,真实世界研究 - 2020-10-03
中药新药用于胃食管反流病的临床疗效评价指导原则(征求意见稿)
为推动构建中医药理论、人用经验和临床试验相结合的中药注册审评证据体系,引导申请人按照“三结合”注册审评证据体系研发符合中医药治疗优势和特点的、用于慢性胃炎、胃食管反
CDE - 胃食管反流病 - 2022-05-06
中药新药用于慢性胃炎的临床疗效评价指导原则(征求意见稿)
为推动构建中医药理论、人用经验和临床试验相结合的中药注册审评证据体系,引导申请人按照“三结合”注册审评证据体系研发符合中医药治疗优势和特点的、用于慢性胃炎、胃食管反流病的中药新
CDE - 慢性胃炎 - 2022-05-06
为您找到相关结果约500个