妊娠期和哺乳期患者用药错误防范指导原则
本指导原则适用于医院机构在涉及妊娠期和哺乳期患者药物治疗的所有医务人员,旨在为防范妊娠期和哺乳期患者发生用药错误提供技术指导,确保妊娠期和哺乳期患者用药安全。
药物不良反应杂志.2017,19(3): - 妊娠期,哺乳期,用药错误 - 2017-09-10
FDA“抗体偶联药物的考虑”供企业用的指导原则草案介绍
FDA于2022年2月发布了“抗体偶联药物的考虑”供企业用的指导原则草案,详细介绍FDA的该指导原则,期望有助于国内对这类新药的研发与监管。
药物评价研究 - 抗体偶联药物 - 2023-06-19
基因治疗血友病临床试验设计技术指导原则
为指导基因治疗血友病临床试验设计,药审中心组织制定了《基因治疗血友病临床试验设计技术指导原则》。
国家药品监督管理局药品审评中心 - 基因治疗血友病 - 2023-04-16
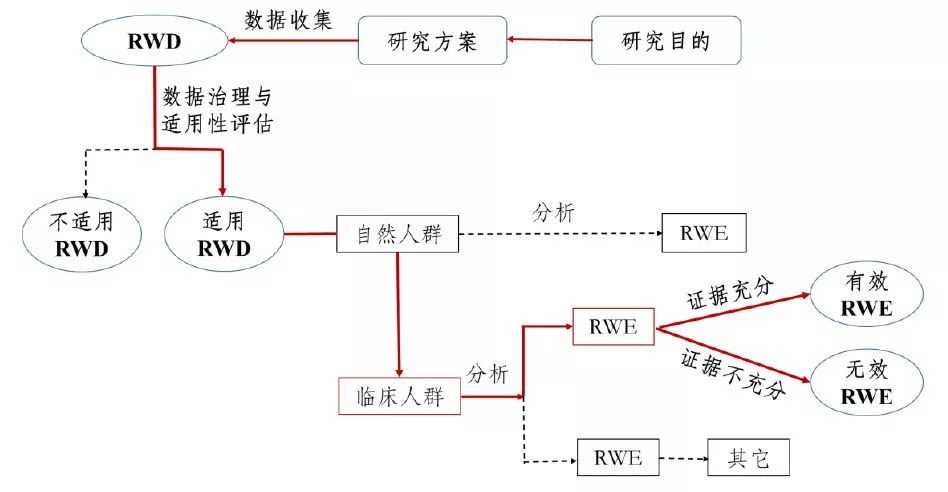
真实世界证据支持药物注册申请的沟通交流指导原则(试行)
为促进真实世界证据在药品注册申请中的应用实践,提高研发效率,针对申请人与审评机构开展真实世界证据支持注册申请的沟通交流给出具体要求和指导性建议,药审中心组织制定了《真实世界证据支持药物注册申请的沟通交
国家药品监督管理局药品审评中心 - 真实世界证据,真实世界证据支持药物 - 2023-02-23
支气管堵塞器、医用导管固定装置注册审查指导原则
为进一步规范医疗器械的管理,国家药监局器审中心组织制修订了《支气管堵塞器注册审查指导原则》、《医用导管固定装置注册审查指导原则》,现予发布。
国家药品监督管理局医疗器械技术审评中心 - 支气管 - 2024-06-03
医用妇科凝胶、 辅助生殖用显微操作管注册审查指导原则
为进一步规范医疗器械的管理,国家药监局器审中心组织制修订了《医用妇科凝胶注册审查指导原则》、《辅助生殖用显微操作管注册审查指导原则》,现予发布。
国家药品监督管理局医疗器械技术审评中心 - 医用妇科凝胶 - 2024-06-06
【中文版】Q3D(R2)元素杂质指导原则
为推动新修订的ICH指导原则在国内的平稳落地实施,我中心拟定了《Q3D(R2):元素杂质指导原则》实施建议,同时组织翻译中文版。本文为Q3D(R2)元素杂质指导原则中文版。
国家药品监督管理局药品审评中心 - 元素杂质 - 2023-07-18
恩扎卢胺软胶囊生物等效性研究技术指导原则
为进一步规范仿制药生物等效性研究,在国家药品监督管理局的部署下,药审中心组织制定了《恩扎卢胺软胶囊生物等效性研究技术指导原则》。
国家药品监督管理局药品审评中心 - 恩扎卢胺软胶囊 - 2024-05-16
FDA指导原则:临床试验中种族和民族数据的收集
本指南的目的是提供 FDA 对在美国和国外进行的 FDA 监管医疗产品临床试验提交中使用标准化方法收集和报告种族和民族数据的期望和建议。使用年龄、性别、性别、种族和民族的标准术语有助于确保一致地收集亚
FDA - 临床试验 - 2021-10-22
古代经典名方中药复方制剂说明书撰写指导原则(试行)
为加快构建中医药理论、人用经验和临床试验相结合的中药注册审评证据体系,规范中医药理论申报资料和古代经典名方中药复方制剂说明书相关内容的撰写,在国家药品监督管理局的部署下,药审中心组织制定了《中药新药复
CDE - 经典名方 - 2021-10-15
基因治疗产品非临床研究与评价技术指导原则(试行)
为规范国内基因治疗产品非临床研究与评价,引导行业健康发展,提高企业研发效率,在国家药品监督管理局的部署下,药审中心组织制定了《基因治疗产品非临床研究与评价技术指导原则(试行)》(见附件1)、《基因修饰
CDE - 基因治疗 - 2021-12-08
生物类似药临床药理学研究技术指导原则
为规范生物类似药的研发和评价,进一步指导生物类似药临床药理学研究,药审中心组织制定了《生物类似药临床药理学研究技术指导原则》(见附件)。
CDE - 生物类似药 - 2022-04-12
人用狂犬病疫苗临床研究技术指导原则(试行)
为指导和规范人用狂犬病疫苗临床试验,提供可参考的技术规范,在国家药品监督管理局的部署下,药审中心组织制定了《人用狂犬病疫苗临床研究技术指导原则(试行)》(见附件)。根据《国家药监局综合司关
CDE - 狂犬病疫苗 - 2022-04-12
为您找到相关结果约500个