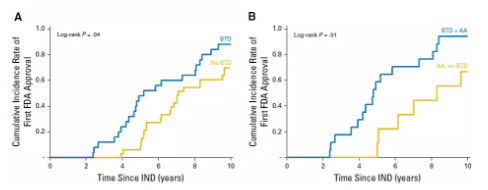
JCO:‘突破性治疗’通道获批的药物都是“神药”吗?
突破性治疗(Breakthrough Therapies),于2012年7月9日在《FDA安全与创新法案》正式公布,旨在提高药物研发上市的速度。那么这项计划是否达到了预期的效果,经该通道批准的药物与未经该通道批准的抗癌药物,在审批时间、有效性和安全性方面究竟有哪些差异,请跟随小编一探究竟。
肿瘤资讯 - 突破性,药物,有效性,安全性 - 2018-04-27
FDA授予GSK药物tafenoquine突破性疗法认定
葛兰素史克(GSK)与非营利组织“抗疟药品事业会”(Medicines for Malaria Venture,MMV)12月20日联合宣布,FDA已授予他非诺喹(tafenoquine)突破性疗法认定,tafenoquine是一种实验性药物,正开发用于间日疟(Plasmodium vivax malaria)的治疗和预防复发。
生物谷 - 新药,FDA - 2013-12-24
罗氏自闭症药物获突破性进展
罗氏(Roche)的balovaptan在美国获得了一项突破性的治疗方案,将其作为一种治疗自闭症谱系障碍(ASD)患者的疗法,可能将药物推向市场的更快路径。临床试验证据表明V1a受体介导和调节重要的社会行为,如重复行为,限制性兴趣和交流问题,这些对于ASD患者来说是
MedSci原创 - 罗氏,自闭症药物 - 2018-01-30
Mavacamten获中国“突破性治疗药物”认证,用于治疗梗阻性肥厚型心肌病
Mavacamten是一种潜在的首创、口服、心肌肌球蛋白别构调节剂,用于治疗以心脏过度收缩和心脏舒张充盈受损为内在原因的疾病。
梅斯医学 - 肥厚型心肌病,Mavacamten - 2022-02-16
肝癌晚期突破性免疫治疗试验
在位于不列颠哥伦比亚的温哥华,Immunitor 公司欣然报道该公司试验成功,试验结果表明其每日一次的口服免疫疫苗 -- hepcortespenlisimut-L (Hepko-V5) 可安全且高效的对晚期肝细胞性肝癌(HCC)患者进行治疗。
Immunitor Inc. - 美通社,肝癌晚期,免疫治疗 - 2017-04-18
复盘新冠时代,那些不得不说的突破性治疗药物
这篇评论文章主要介绍了在大流行期间应对COVID-19、埃博拉病毒病(EVD)、心脏病、癌症、阿尔茨海默病、糖尿病和疟疾最具影响力的突破性医学创新,这些创新对人类具有深远的意义和积极的影响。
生物探索 - 突破性治疗药物,新冠 - 2022-02-17
Nature:让研究人员目瞪口呆的“突破性”肥胖药物!
该分子是利拉鲁肽的改良版本,作用于相同的途径,但在体内保持完整和活跃的时间更长。
转化医学网 - 脂肪,突破性,肥胖药物 - 2023-01-05
Lanifibranor治疗NASH:FDA授予“突破性疗法称号”
美国食品和药品监督管理局(FDA)授予该公司的主要候选药物Lanifibranor治疗非酒精性脂肪性肝炎(NASH)的“突破性疗法称号”。
MedSci原创 - NASH,非酒精性脂肪性肝炎(NASH),突破性疗法,lanifibranor - 2020-10-13
ALK阳性NSCLC治疗药物Aalectinib被FDA授予突破性药物资格
罗氏旗下Genentech于10月4日称:成人晚期ALK阳性非小细胞肺癌(NSCLC)一线治疗药物——肺癌新药Alecensa(alectinib)——获FDA授予突破性药物资格。FDA此决定主要基于J-ALEX研究的结果;该研究为开放标签、3期试验,纳入了207例未经治疗的ALK阳性、晚期或复发性NSCLC患者,被随机分为alectinib (Alecensa, Genentech
MedSci原创 - ALK,NSCLC,Aalectinib,FDA,突破性药物 - 2016-10-05
汇总:FDA授予突破性疗法认定(BTD)药物,癌症类占43%
突破性疗法认定(breakthrough therapy designation,BTD)由美国食品和药物管理局(FDA)于2012年7月创建,源于《美国食品和药物管理局安全及创新法案》(FDASIA)中制定的部分内容,旨在加速开发及审查治疗严重的或威胁生命的疾病的新药。突破性疗法认定(BTD)是继快速通道(Fast Track)、加速批准(Accelerated Approval)、优先审评
生物谷 - FDA,癌症,(BTD)药物 - 2015-02-27
GSK旗下肺癌药物Tafinlar获FDA突破性治疗药物资格
葛兰素史克肺癌药物Tafinlar (dabrafenib)获得突破性治疗药物资格,目前正处于FDA快通道审评中。这款药物适用于之前至少接受过铂类药物治疗的患者。此举是基于的Tafinlar的2期临床试验中期有效性及安全性数据而出的,该试验受试者为BRAF V600E突变患者,NSCLC患者中有2%的人属于这类患者。
dxy - Tafinlar,GSK,肺癌药物,FDA - 2014-01-16
InterMune治疗IPF药物获得FDA突破性药物认证
InterMune公司最近透露FDA已经确认授予其开发的治疗原发性肺纤维化(IPF)药物prifenidone突破性药物疗法,但并不会加快FDA对该药物的上市审核进程。在FDA的先期审查中,pirfenidone已经获得了相关专家的高度认可,因而此次获得突破性药物认证可能并不会加速这一药物的审核。按照原计
生物谷 - FDA,原发性肺纤维化 - 2014-07-23
雅培生命旗下丙肝复方药物获FDA突破性治疗药物资格
5月6日,雅培生命表示美国食品药品管理局(FDA)授予其抗丙肝病毒复方药物突破性治疗药物资格,该资格的获得将有助于加快这一复方药物的审评进度,或许还能缩短其临床试验过程。雅培生命的这款复方药物由ABT-450/r(蛋白酶抑制剂和利托那韦)、ABT-267(NS5A抑制剂)和ABT-333(非核苷聚合酶抑制剂)组成,此外还可加或不加利巴韦林。其突破性治疗药物资格是紧继吉利德的Sofosbuvir
dxy - 雅培,丙肝,复方药物,FDA,突破性,治疗药物 - 2013-05-09
勃林格肺纤维化药物Nintedanib获FDA突破性治疗药物资格
勃林格殷格翰旗下用于罕见致命肺疾病的药物Nintedanib获得FDA授予的突破性治疗药物资格,这代表该药物获得了一个加快的监管审评,并且可能会帮助Nintedanib打败其竞争对手而上市。Nintedanib是一款用于特发性肺纤维化(IPF)的治疗药物,IPF通常是一种致命性疾病,可以使肺出现创伤,并阻碍氧气吸入。在两项1000多名患者参与的3期试验中,勃林格殷格翰的治疗药物使患者肺功能年下
dxy - 药物,勃林格肺纤维化 - 2014-07-18
FDA突破性药物疗法认证:治疗罕见癌症新药pexidartinib
日本著名药企第一三共最近宣布公司开发的新药pexidartinib已经获得了FDA的突破性药物疗法认证。这也标志着这种疗法将正式走上优先审批的道路。Pexidartinib是一种用于治疗腱鞘巨细胞瘤(TGCT)的新药。腱鞘巨细胞瘤是一种罕见的腱鞘癌。目前临床上一般是通过手术切除的方法来治疗这种疾病,但是由于TGCT具有多个类型,并且一般发生在骨组织和关节处,因此使得临床上急需新的介入疗法的
生物谷 - 基因治疗,癌症 - 2015-11-03
为您找到相关结果约500个