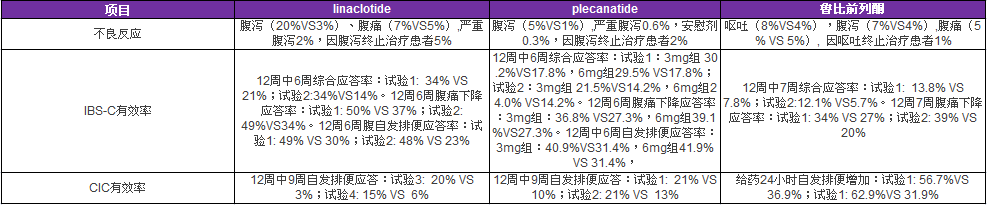
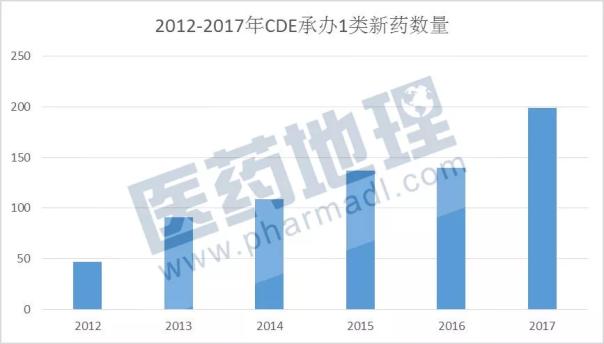
2018美国新药批准量创历史新高 它在释放什么信号
2018年,美国FDA共批准61种药物,其中59种由CDER批准,另外两种由CBER批准。然而,除了获批新药数量庞大,新药的质量也让2018年成为制药行业的分水岭。53家公司共获得61项药品批准61项获批新药按时间顺序排列如下:只有6家公司获得多项批准:辉瑞有4项,Array、阿斯利康、礼来、Shionogi和Shire各2项。由于1
健康界 - 美国新药 - 2019-01-22
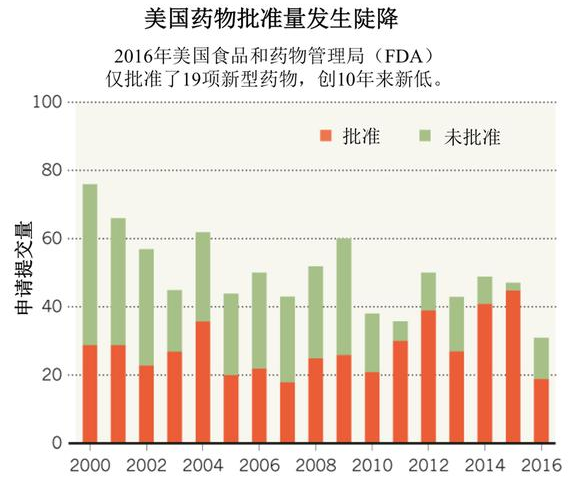
美国食药监局新药批准量创十年来新低
前不久,美国食品和药物监管局(FDA)发布的报告中指出,和2015年相比,2016年美国药品批准预计将下降一半以上。 截至2016年12月9日,今年FDA已经批准了19项新药物,而这使今年成为自2007年以来批准药物量最低的年份。2015年FDA一共批准了45项新药物,是近20年来批准量最高的一年。
DeepTech深科技 - 美国食药监局,新药批准量 - 2016-12-23
化药创新药临床申请量翻番
近日,国家食品药品监督管理总局发布《2017年度药品审评报告》指出,我国去年共审评批准化药创新药临床试验申请399件,涉及170个品种,较2016年创新药临床试验批准数量翻了一番;在审评批准创新药临床试验的品种中
健康报 - 化药,创新药,临床申请 - 2018-03-26
美国FDA批准首个干眼症新药
Shire公司宣布美国FDA已经批准其新药Xiidra滴眼剂溶液(5%浓度的lifitegrast眼用溶液)上市,每日使用两次,治疗成人干眼症患者。干眼症是一种与眼球表面以及眼泪分泌相关的多因素疾病,表现为泪液质、量异常或动力学异常,并伴有如眼睛干涩、整体眼部
生物谷 - FDA,干眼症,新药 - 2016-07-13
五种新药获欧盟批准
五种新药获得欧盟批准,其中包括两种针对罕见疾病的孤儿药。首先,欧洲药品管理局人用药品委员会(CHMP)批准AMMTeK的Amglidia(格列本脲)用于治疗新生儿,婴儿和儿童中的新生儿糖尿病。
MedSci原创 - 新药,欧盟批准 - 2018-02-27
FDA批准首个狼疮肾炎口服新药
1月22日,Aurinia制药公司宣布FDA批准Lupkynis(voclosporin,伏环孢素)上市,联合免疫抑制疗法治疗成人活动性狼疮肾炎(LN)。Lupkynis是FDA批准的首个狼疮肾炎口服
医药魔方 - 狼疮肾炎 - 2021-01-25
CHMP建议批准ViiV HIV新药Tivicay
葛兰素史克(GSK)和辉瑞(Pfizer)合资公司ViiV Healthcare 11月21日宣布,HIV新药Tivicay(dolutegravir,50mg片剂)上市许可申请(MAA)获得了欧洲药品管理局CHMP建议批准Tivicay联合其他抗逆转录病毒药物用于HIV成人感染者和12岁以上青少年感染者的治疗。 CHMP的积极意见,是基于
生物谷 - 新药,FDA - 2013-11-25
首个减少HIV 病毒载量在研新药初期临床成功
今天,创新生物技术公司 ABIVAX 宣布,接受了该公司先导新药候选物 ABX464 的慢性人类免疫缺陷病毒(HIV,俗称艾滋病病毒)感染者首次显示了体内病毒载量的减少,这是通过在外周血液单核细胞(PBMC
药明康德 - HIV - 2017-05-03
2017年FDA批准的41个新药
截止目前,CDER已经批准了41个新分子实体,还有2个药物的PDUFA最后期限落在12月,如12月间FDA不加速批准新药,那么2017年获批的新分子实体可能是41-43个。当然本文所涉及的新药,均为 CDER 受理的 NDA 或 BLA,并不包括CBER审评的品种,如 CAR-T 产品。相对去年的20来个,今年算是一个丰收年。已经获批的41个产品中,有31个是全球首次批准,19个产品获得了优先
科睿唯安生命科学与制药 - FDA,新药 - 2017-12-06
FDA 上半年批准的新药汇总
今天汇总一下FDA上半年批准的新药,共26款,Q1和Q2各13款,要显著多于去年上半年的16款。其中辉瑞表现强劲,获得三款新药批准。
药研网 - 新药汇总 - 2023-07-14
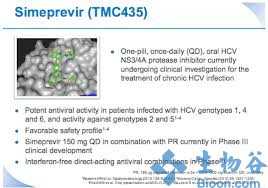
强生丙肝新药OLYSIO(simeprevir)获FDA批准
强生(JNJ)11月22日宣布,丙肝新药OLYSIO(simeprevir)已获FDA批准,联合聚乙二醇干扰素和利巴韦林(ribavirin),用于基因型1慢性丙型肝炎成人患者代偿性肝脏疾病(包括肝硬化此前,FDA已于今年5月授予simeprevir新药申请(NDA)优先审查资格,同时该药于今年10月获得了FDA顾问委员会建议批准的积极意见。 Simeprevir监管文件的提交
生物谷 - 新药,FDA - 2013-11-25
FDA批准治疗热带疾病新药
FDA日前批准Impavido(米替福斯)治疗热带病利什曼病(leishmaniasis),该病是苍蝇叮咬引起,由寄生虫传染给人类。Impavido由加拿大Paladin公司生产,被批准用于治疗3种主要类型利什曼病。 Impavido获得FDA快速审批,优先审查和罕用药资格认定。
医药经济报 - 新药,FDA - 2014-04-04
2014上半年FDA批准的新药
2014年已走过一半时间,仅从FDA的新药审批结果来看,医药行业吹来暖风。2014上半年FDA批准了18个新药,相比2013上半年有明显增长。由于2012年小型制药企业递交新药上市申请的数量激增,FDA的新药批准数量在2012年达到了39个的历史高点。随着2013年FDA批准的新药数量急剧下降至27个,人们也开始对全球新药研发
生物探索 - 新药,FDA - 2014-07-02
2012年1月FDA批准新药概况
从FDA网站获悉,2012年1月批出生物制剂新药1个,新分子实体(NME)药品3个,新剂型药品3个。涉及辉瑞、基因泰克、GILEAD等多家医药企业。表:2012年1月FDA批准新药 商品名 通用名(中文) 公司 规格 剂型 批准类型 批准日期 VORAXAZE GLUCARPIDASE
MedSci原创 - FDA,新药 - 2012-02-04
为您找到相关结果约500个