JCO:Nivolumab联合Relatlimab在晚期黑色素瘤中诱导持久反应
2023-03-19 网络 网络 发表于上海
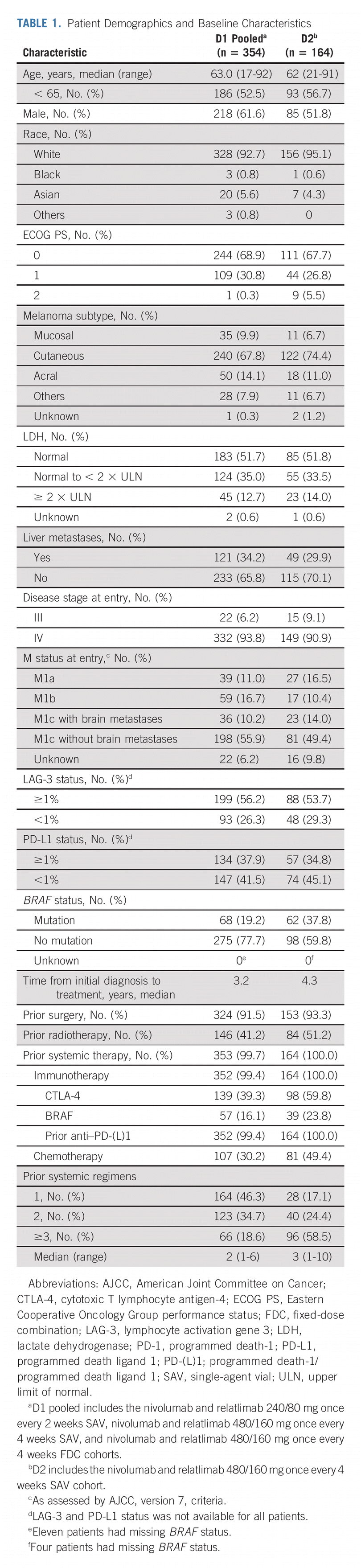
nivolumab (nivolumab) 和 relatlimab (Opdualag) 的组合在既往 PD-L1 或 PD-1 抑制剂治疗后进展的晚期黑色素瘤患者中证明了临床益处和可控的安全性,无
nivolumab (nivolumab) 和 relatlimab (Opdualag) 的组合在既往 PD-L1 或 PD-1 抑制剂治疗后进展的晚期黑色素瘤患者中证明了临床益处和可控的安全性,无论 PD-L1 和 LAG-3 表达如何, 根据正在进行的 1/2a 期 RELATIVITY-020 试验 (NCT01968109).[1] 的结果。relatlimab作为第一个问世的LAG3抗体,备受关注:LAG3 能否掀起免疫治疗下一波热潮?
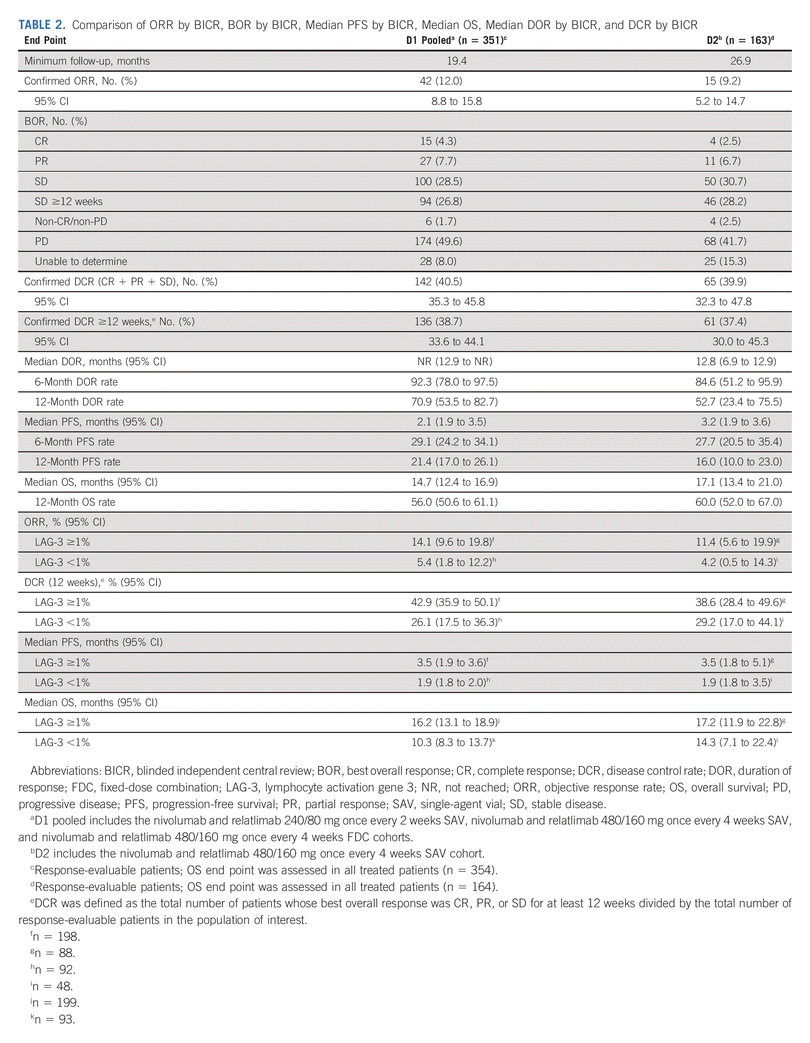
在 2021 年 1 月 4 日的临床截止日期和至少 19.4 个月的随访期间,在可评估的患者中,盲法独立中央审查 (BICR) 得出的总体缓解率 (ORR) 为 12.0%(95% CI,8.8% -15.8% 在使用 1 种既往 PD-1 抑制剂(D1;n = 351)时进展的患者,在使用至少 1 种既往 PD-1 时进展的患者中为 9.2%(95% CI,5.2%-14.7%) /PD-L1 抑制剂(D2;n = 163)。
“在接受基于抗 PD-1 的治疗后进展的晚期黑色素瘤患者中,nivolumab 加 relatlimab 引发了持久的肿瘤消退,并且具有可控的安全性,”巴尔的摩 Sidney Kimmel 综合癌症中心的医学博士 Evan J. Lipson说。
此前,2/3 期 RELATIVITY-047 试验 (NCT03470922) 研究了 PD-1 抑制剂 nivolumab 与 LAG-3 抑制剂 relatlimab 的固定剂量组合,对比 nivolumab 单药治疗先前未治疗的晚期黑色素瘤患者 , 表明与单独使用 nivolumab 相比,该组合显着改善了中位无进展生存期 (PFS),分别为 10.2 个月 (95% CI, 6.5-14.8) 和 4.6 个月 (95% CI, 3.5-6.4; HR, 0.78, 95%) CI,0.6-0.9),中位随访时间为 19.3 个月。 此外,BICR 的中位 ORR 在接受联合治疗的患者中为 43.1%(95% CI,37.9%-48.4%),而在单独接受纳武单抗治疗的患者中为 32.6%(95% CI,27.8%-37.7%)[2]。 RELATIVITY-047 的研究结果支持 FDA 于 2022 年 3 月批准固定剂量 relatlimab 加 nivolumab 用于至少 12 岁的不可切除或转移性黑色素瘤患者。详细见:NEJM:第三代免疫检查点上场:LAG-3+PD-1,晚期癌症无进展生存期提高一倍
开放标签、剂量递增和队列扩展 RELATIVITY-020 试验评估了 relatlimab 单一疗法和 relatlimab 加 nivolumab 在晚期实体瘤患者中的疗效、安全性和耐受性。 该试验的 D 部分调查了 relatlimab 加纳武单抗在 1 种含 PD-1 方案 (D1) 或至少 1 种 PD-1/PD-L1- 期间或 3 个月内进展的晚期黑色素瘤患者的疗效和安全性。
要参加 RELATIVITY-020,患者需要有组织学或细胞学证实的转移性和/或不可切除的实体恶性肿瘤。 如果患者在使用 PD-L1 或 PD-1 抑制剂期间患有晚期不可切除或转移性黑色素瘤并且疾病进展,则他们有资格参加 D 部分。
在 D1 部分,患者需要在晚期/转移性情况下接受过 1 种既往 PD-1 抑制剂,特别是 nivolumab 或 pembrolizumab (Keytruda),并且在接受最后一次剂量后 3 个月内使用该药物取得进展。 允许接受过先前含 CTLA-4 方案的患者,包括 CTLA-4 抑制剂联合 PD-1 抑制剂。 如果患有 BRAF 突变疾病的患者在晚期/转移性环境中接受过 1 种 BRAF 抑制剂治疗并在先前的治疗中出现进展,则也被允许。 然而,如果患者之前接受过 LAG-3 或 PD-L1 抑制剂,或者他们接受过辅助或新辅助 PD-1/PD-L1 抑制剂,则被排除在外。 D1 中的所有患者的 ECOG 体能状态 (PS) 都需要为 0 或 1。
在 D2 部分中,患者可能已经接受过多种 PD-1 或 PD-L1 抑制剂。 既往接受过辅助或新辅助 PD-1 抑制剂治疗的患者,如果他们在治疗期间或在最后一次辅助剂量后 6 个月内在这些药物上取得进展,或者如果他们随后在针对转移性疾病的额外 PD-1 治疗中取得进展,则可以入组。 患者可能已经接受过多种先前的 BRAF 抑制剂治疗,但患有 BRAF 突变疾病的患者不需要在这些药物上取得进展。 D2 中的所有患者都需要具有 0 至 2 的 EGOG PS。
总共有 518 名患者(D1,n = 354;D2,n = 164)接受了 nivolumab 加 relatlimab。 D1 中的患者每 2 周接受一次 240 mg nivolumab 和 80 mg relatlimab (n = 189;D1 每 2 周一次)或按 1:1 随机接受 480 mg nivolumab 和 160 mg relatlimab 每 4 周一次 (n = 83) 或每 4 周一次作为固定剂量组合 (n = 82;D1 每 4 周一次)。 D2 中的患者每 4 周接受一次 480 mg nivolumab 和 160 mg relatlimab 。
D 部分的主要终点是安全性,通过不良反应 (AE) 的发生率来衡量; 严重的不良事件; 导致治疗中断、死亡和实验室异常的不良事件。 每 2 周一次的 D1 中的共同主要终点是根据 RECIST v1.1 标准在具有 LAG-3 表达的患者中通过 BICR 得出的 ORR。 每 4 周一次的 D1 中的共同主要终点是安全性,通过给药后 2 天内超敏反应或输液相关反应的发生率来衡量。 另一个共同主要终点是每 2 周一次 240 mg nivolumab 加 80 mg relatlimab 相对于每 4 周一次 480 mg nivolumab 加 160 mg relatlimab 的安全性。
在 D1 和 D2 中,分别有 53.3% 和 58.5% 的患者接受过至少 2 种和至少 3 种既往治疗。 在 D1 和 D2 中,39.3% 和 59.8% 的患者既往接受过 CLTA-4 抑制剂,16.1% 和 23.8% 的患者既往接受过 BRAF 抑制剂,分别有 30.2% 和 49.4% 的患者既往接受过化疗。
D1组的中位治疗持续时间约为 16 周(范围 2-160 周),固定剂量组合组的中位治疗持续时间约为 19.8 周(范围 4-128 周)。
在 D1 中,BICR 的 ORR 在 LAG-3 表达至少为 1% 的患者中为 14.1%(95% CI,9.6%-19.8%),在 LAG-3表达低于1%。 在 PD-L1 表达至少为 1% 的 D1 患者中,BICR 的 ORR 为 15.7%(95% CI,10.0%-23.0%),在 PD 患者中为 8.2%(95% CI,4.3%-13.8%) -L1表达小于1%。
在 D1 中有和没有既往 CLTA-4 暴露的患者中,BICR 的 ORR 分别为 11.7%(95% CI,6.8%-18.3%)和 12.1%(95% CI,8.1%-17.3%)。 在既往使用过和未使用过 BRAF 或 MEK 抑制剂的 D1 患者中,BICR 的 ORR 分别为 13.5%(95% CI,5.6%-25.8%)和 12.5%(95% CI,1.6%-38.3%)。
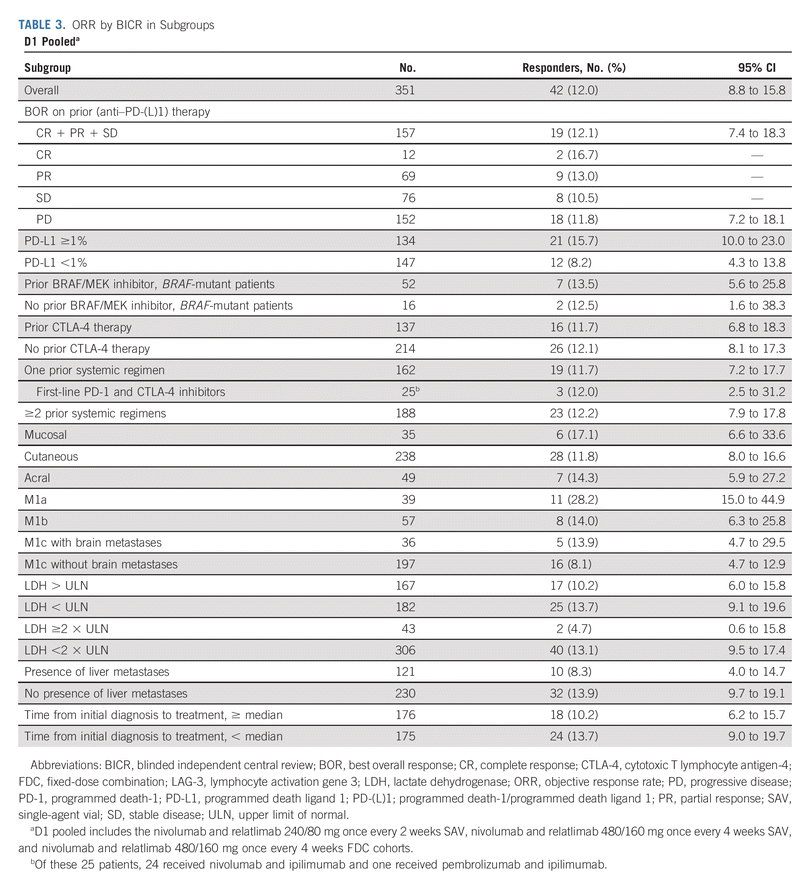
在患有 M1c 疾病的 D1 患者中,BICR 的 ORR 在有脑转移的患者中为 13.9%(95% CI,4.7%-29.5%),在无脑转移的患者中为 8.1%(95% CI,4.7%-12.9%) . 在乳酸脱氢酶水平高于或低于正常上限的 D1 患者中,BICR 的 ORR 分别为 10.2%(95% CI,6.0%-15.8%)和 13.7%(95% CI,9.1%-19.6%) )。
D1和D2通过BICR确认的疾病控制率分别为40.5%和39.9%。
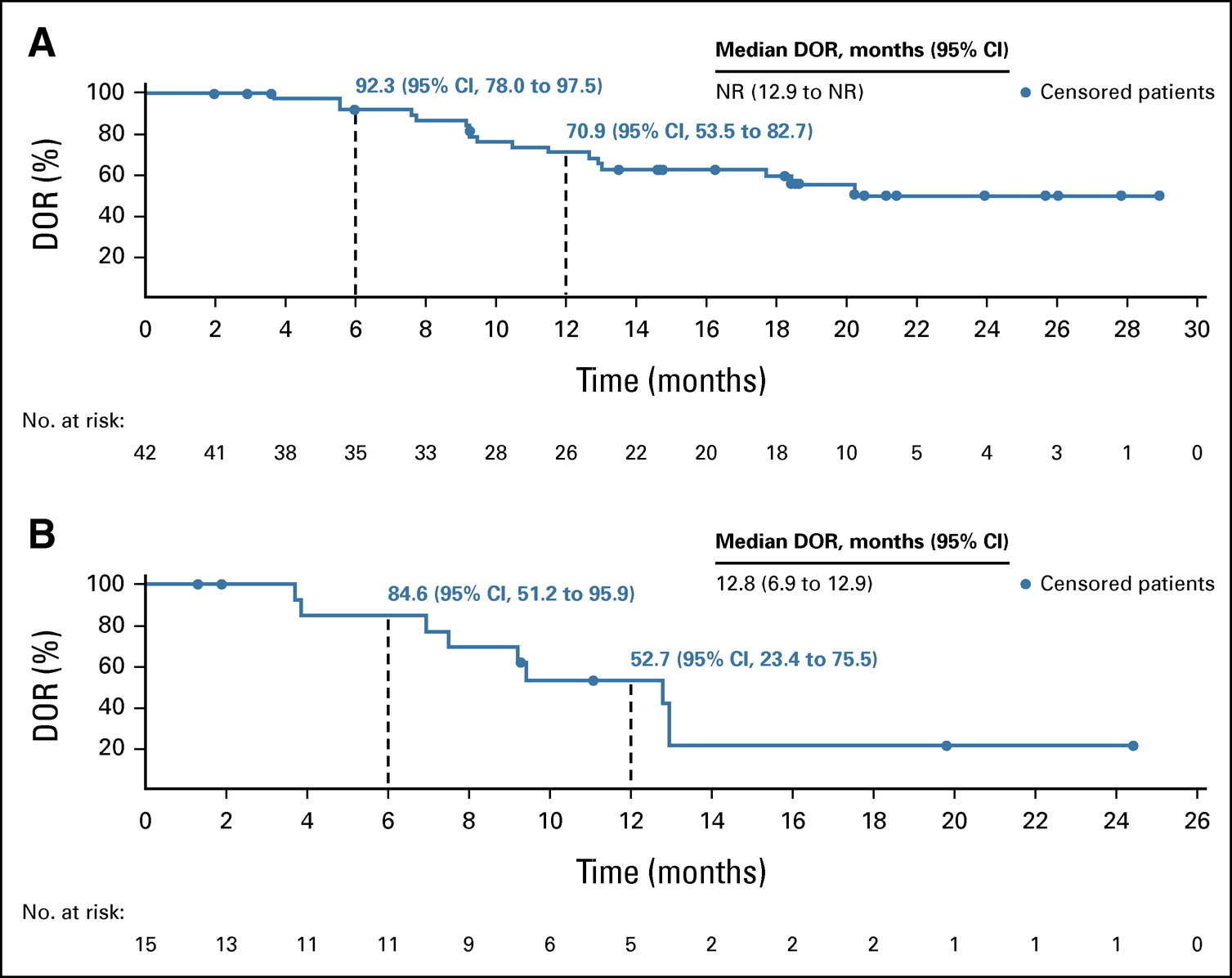
D1 未达到中位反应持续时间(NR;95% CI,12.9-NR),D2 为 12.8 个月(95% CI,6.9-12.9)。 在 D1 中,6 个月和 12 个月的缓解率分别为 92.3%(95% CI,78.0%-97.5%)和 70.9%(95% CI,53.5%-82.7%)。 在 D2 中,6 个月和 12 个月的缓解率分别为 84.6%(95% CI,51.2%-95.9%)和 52.7%(95% CI,23.4%-75.5%)。
BICR 的中位 PFS 在 D1 中为 2.1 个月(95% CI,1.9-3.5),在 D2 中为 3.2 个月(95% CI,1.9-3.6)。在 D1 和 D2 中,6 个月 PFS 率为 29.1%(95% CI,24.2%) -34.1%)和 27.7%(95% CI,20.5%-35.4%)和 12 个月 PFS 率为 21.4%(95% CI,17.0%-26.1%)和 16.0%(95% CI,10.0%-23.0) %) 。
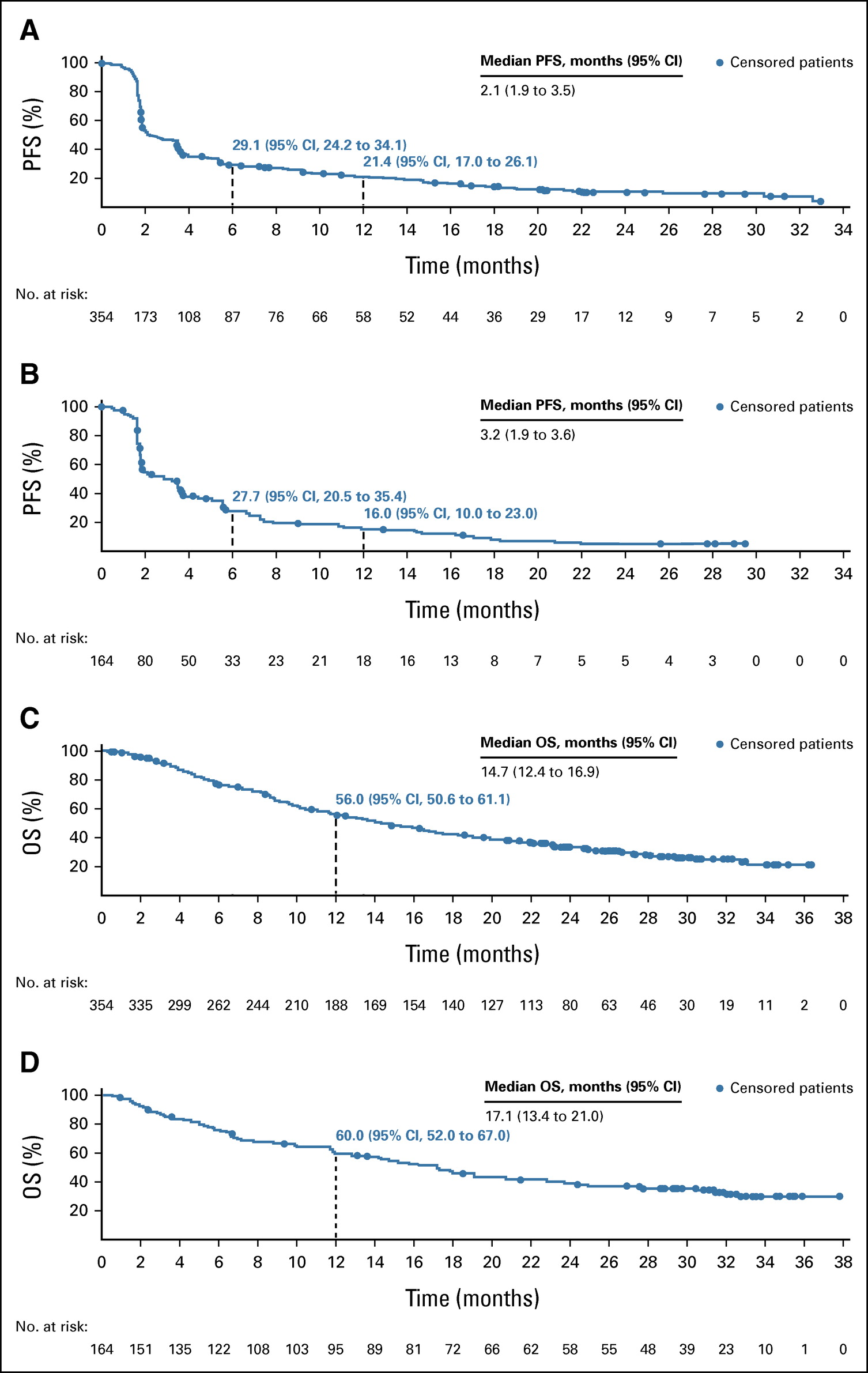
D1 的中位总生存期 (OS) 为 14.7 个月 (95% CI, 12.4-16.9),D2 为 17.1 个月 (95% CI, 13.4-21.0),12 个月 OS 率为 56.0% (95% CI, 12.4-21.0) D1 和 D2 分别为 50.6%-61.1%) 和 60.0% (95% CI, 52.0%-67.0%)。
接受D1联合治疗的患者与接受固定剂量联合治疗的患者之间的关键药代动力学参数相似。 在每 4 周一次的 D1 队列中,第 29 天出现大约 50% 的 sLAG-3 水平下降。 研究人员观察到,在每 4 周一次的 D1 队列中,sLAG-3 从基线到第 15 天的变化没有差异。 在每 4 周一次的 D1 队列中,与基线相比,联合治疗导致血清干扰素-γ 水平增加约 2 倍。
在 D1 中 67.5% 的患者和 D2 中 68.9% 的患者发生任何级别的治疗相关 AE (TRAE)。 3/4 级 TRAE 发生在 D1 中 15.0% 的患者和 D2 中 12.8% 的患者中。 在 D1 和 D2 中,导致治疗中断的任何级别 TRAE 的发生率分别为 5.1% 和 4.3%。
在 D1 中,最常见的免疫介导的 AE 是皮疹 (7.3%)、甲状腺功能减退症或甲状腺炎 (5.9%) 以及腹泻或结肠炎 (5.4%)。 在 D2 中,最常见的免疫介导的 AE 是皮疹 (8.5%)、甲状腺功能减退症或甲状腺炎 (4.3%) 和肝炎 (4.3%)。
在每 2 周一次的 D1 队列中,治疗相关的超敏反应或输液相关反应的发生率为 8.5% (n = 16),在每 4 周一次的 D1 单剂小瓶队列中为 3.6% (n = 3),并且 7.3% (n = 6) 在 D1 每 4 周一次的固定剂量组合队列中。 没有发生 3/4 级超敏反应或输注相关反应。
D1 中的一名患者发展为 3 级心肌炎。 D部分没有发生与治疗相关的死亡。
这些结果证明了 nivolumab 和 relatlimab 在接受含抗 PD-(L)1 方案后进展的晚期黑色素瘤患者中的安全性和临床活性,包括接受过大量预处理、既往接受过 CTLA-4 抑制剂并且有多种预后不良的因素。 结合 RELATIVITY-047 的结果,这些发现证明了 nivolumab 和 relatlimab 双重免疫疗法在晚期黑色素瘤中的跨线治疗活性。
参考资料:
- Ascierto PA, Lipson EJ, Dummer R, et al. Nivolumab and relatlimab in patients with advanced melanoma that had progressed on anti-programmed death-1/programmed death ligand 1 therapy: results from the phase I/IIa RELATIVITY-020 trial. J Clin Oncol. Published online February 13, 2023. doi:10.1200/JCO.22.02072
- Long GV, Hodi SF, Lipson EJ, et al. Relatlimab and nivolumab versus nivolumab in previously untreated metastatic or unresectable melanoma: overall survival and response rates from RELATIVITY-047 (CA224-047). J Clin Oncol. 2022;40(36):360385. doi:10.1200/JCO.2022.40.36_suppl.360385
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言