JHO:奥加伊妥珠单抗治疗成人急性淋巴细胞白血病:过去、现在和将来
2024-05-15 聊聊血液 聊聊血液 发表于威斯康星
MD安德森癌症中心学者讨论了INO在ALL中的临床发展,强调了INO最初临床试验获得的经验教训,以及许多正在进行的、旨在扩大INO在ALL中作用的研究。
奥加伊妥珠单抗
奥加伊妥珠单抗(Inotuzumab ozogamicin,INO)是一种抗CD22抗体-药物偶联物,获批治疗复发性或难治性(R/R)前体B细胞急性淋巴细胞性白血病(ALL)成年患者,但在一线和挽救治疗中,INO联合化疗和/或贝林妥欧单抗也取得非常好的结果。
《Journal of Hematology & Oncology》近日发表综述“Inotuzumab ozogamicin for the treatment of adult acute lymphoblastic leukemia: past progress, current research and future directions”,MD安德森癌症中心学者讨论了INO在ALL中的临床发展,强调了INO最初临床试验获得的经验教训,以及许多正在进行的、旨在扩大INO在ALL中作用的研究,包括将其联合化疗和/或其他免疫治疗用于ALL的一线治疗以及可测量残留病(MRD)的治疗。

奥加伊妥珠单抗(INO)开发于21世纪初,在关键性 INO-VATE 研究中,与常规化疗相比,INO显著改善缓解率和总生存期 (OS)。图1为其临床开发的时间轴。
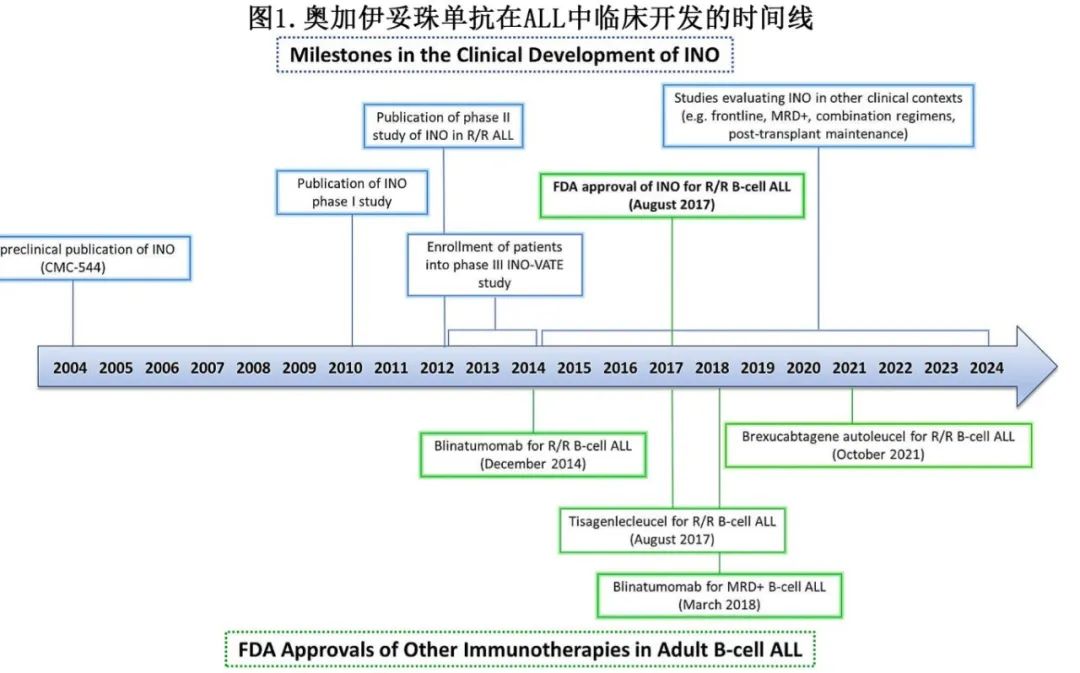
药物机制和临床前开发
INO 是一种 IgG 抗 CD22 单克隆抗体药物偶联物,由Celltech和Wyeth(2009年被辉瑞收购)开发。INO可与细胞毒性药物刺孢霉素相偶联,当CD22与其配体或相应抗体结合后能迅速内化进入细胞,释放刺孢霉素发挥抗肿瘤活性。INO首次在临床前研究中显示对 B 细胞淋巴瘤细胞系具有活性,随后在侵袭性 B 细胞淋巴瘤小鼠模型中进行研究,显示具有单药治疗活性以及与利妥昔单抗或化疗(包括 CVD 和CHOP)的协同作用。鉴于 INO 在 B 细胞淋巴瘤模型中具有明确的临床前活性,进一步在CD 22 阳性 ALL 模型中对其进行研究,结果显示其可诱导小鼠肿瘤完全消退和治愈,具有在 ALL 中进行临床开发的价值。
I期和II期研究
INO 首项人体研究是在R/R CD22 阳性 B 细胞非霍奇金淋巴瘤成人患者中开展的 I 期研究。纳入79例患者接受治疗,最大耐受剂量 (MTD) 为1.8mg/m2,每3-4周单次给药。血小板减少症为剂量限制性毒性,90%的患者发生所有级别血小板减少症,其中63%的患者≥3级。观察到较高活性,所有患者中总缓解率为39%,其中滤泡性淋巴瘤和弥漫性大 B 细胞淋巴瘤中分别为69%和15%。后来III 期淋巴瘤关键研究未达到主要研究终点,而ALL初探性研究显示出较好结果,从而将重点转移到ALL。
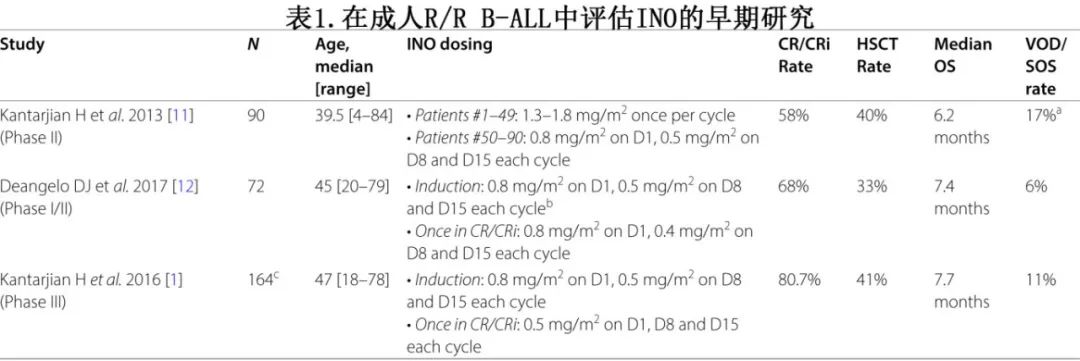
MD安德森癌症中心研究者发起的 II 期研究在儿童和 CD22 阳性复发性或难治性 ALL 成人患者中评价了INO(表1)。在首次报道中,49例患者接受剂量为1.3 mg/m2至1.8 mg/m2的INO,每3-4周给药一次。该人群既往接受过多线治疗,73%的患者作为二次及以上挽救治疗。完全缓解 (CR)/CR伴不完全血液学恢复 (CRi) 率为57%,中位 OS 为5.1个月。最常见的不良事件为发热 (59%)、转氨酶升高 (57%) 和高胆红素血症 (29%)。此外异基因造血干细胞移植 (HSCT)增加毒性风险,在 INO 后接受 HSCT 的26例患者中,1年 OS 率仅为20%,原因在于非复发死亡率 (NRM) 较高和5例因肝窦阻塞综合征 (SOS)/肝小静脉闭塞病(VOD)导致的死亡。为改善 INO 的安全性/疗效而对研究进行了修订,将 INO 的剂量进行分割,并在第1天给予0.8 mg/m2,在第8天和第15天给予0.5 mg/m2,每3-4周给药一次,该依据为较低剂量和更自由的 INO 给药方案可改善抗 ALL 疗效(主要由曲线下面积决定),同时降低毒性(主要由 INO 的峰值水平决定)。在随后的分析中,共治疗了90例患者(原始方案49例,新方案41例),缓解率和生存期结局相似。但新的给药方案更安全,发热、低血压和高胆红素血症的发生率更低,SOS/VOD 发生率也更低(7%,而原方案为17%),可能是由于分次给药以及更好地了解 INO 的 SOS/VOD 风险,导致 HSCT前预处理减少使用烷化剂。
INO 的安全性和有效性后来被一项I/II 期多中心研究证实,该研究在成人R/R ALL中评价 INO(表1);该研究还评价了INO分次每周给药(每周期1.2 mg/m2至1.8 mg/m2),最多6个周期。推荐的 II 期剂量为1.8 mg/m2/周期,一旦达到CR/CRi则剂量减至1.6 mg/m2。72例患者接受治疗,其中78%的患者为2次及以上挽救治疗,约三分之一的患者既往接受过异基因HSCT。结果CR/CRi率为68%(包括32%的CR),中位 OS 为7.4个月。三分之一的患者接受了后续异基因HSCT,SOS/VOD 4例(共6%)。
III期研究 (INO-VATE)
疗效和安全性结局
基于 INO 治疗 B-ALL 的2项既往临床研究中较高的安全性和疗效数据,学者设计了关键INO-VATE 研究,在R/R CD22 阳性成人 B-ALL患者中比较 INO 与常规化疗(表1)。326例患者按1:1的比例随机接受 INO 或联合化疗(氟达拉滨、阿糖胞苷和粒细胞刺激因子 [FLAG]、阿糖胞苷+米托蒽醌或高剂量阿糖胞苷)。鉴于每周给药的优越安全性,INO在第1天以0.8 mg/m2的剂量给药,在第8天和第15天以0.5 mg/m2的剂量给药,最多6个周期。两组的中位年龄均为47岁,INO组32%的患者和对照组36%的患者为二次挽救治疗。INO组的 CR/CRi 率显著高于常规化疗组(80.7% vs. 29.4%;P<0.001)。除t(4;11) 患者外,所有亚组中均观察到 INO 缓解率更佳,但该亚组患者数量较少。在缓解者中,INO还与较高的MRD(多参数流式细胞术)阴性率(分别为78.4%和28.1%;P<0.001)和后续 HSCT 率(分别为41%和11%;P<0.001)相关。在较高缓解率和 HSCT 率的驱动下,INO使中位 OS 显著更佳(7.7个月 vs. 6.7个月;P=0.04)。在长期生存结局中观察到 INO 的最大获益,与化疗相比,INO使2年 OS 率增加一倍以上(分别为23% vs. 10%)。发热性中性粒细胞减少和血小板减少在对照组中更常见,而肝脏相关不良事件在INO中更常见;INO和化疗的SOS/VOD率分别为11%和1%。基于缓解率和OS的较高改善,FDA于2017年8月批准INO用于治疗成人复发性/难治性B细胞ALL。
亚组分析,包括移植结局
INO-VATE 研究已发表多项亚组分析,它们强调了使用 INO 的重要考虑因素,包括其良好疗效(不考虑骨髓原始细胞百分比、髓外受累或 CD22 表达)及其在费城染色体 (Ph) 阳性 ALL 中的疗效。INO可实现较高HSCT 率,根据多因素分析,移植是 INO 治疗后 OS 的最显著预测因素。在 INO-VATE 研究中接受 INO 治疗并达到 CR/CRi 的患者中,接受后续异基因HSCT的患者结局最佳(中位 OS 12.6个月和2年OS 率 39% vs 未移植患者中位 OS 7.1个月和2年 OS 率13%)。但移植也伴随着 INO 后 SOS/VOD 的高风险(23% vs未移植患者的9%),从而导致 INO 相关非复发死亡。因此,必须正确选择 INO 的患者和缓解策略,以防止该并发症。在2项 INO 研究的汇总分析中观察到相似的移植后结果,INO 后接受异基因HSCT 的患者的 HSCT 后中位 OS 为9.2个月,HSCT后2年 OS 率为41%。在这两项研究中,移植患者的 SOS/VOD 总发生率为18%。
多项 INO 研究的汇总分析可以更好地了解 SOS/VOD 风险,在这些研究中,发生 SOS/VOD 的预测因素包括:年龄较大、HSCT预处理使用含2种烷化剂的方案、治疗前转氨酶和/或胆红素升高、INO治疗周期数较多和累积剂量较高以及既往多种 ALL 治疗(尤其是既往HSCT)。随后制定了共识指南来缓解这些风险。接受 INO 治疗的患者预防 SOS/VOD 风险的重要考虑因素包括:正确选择患者(例如,在重度基础肝功能不全患者中避免使用),在移植患者中避免使用含2种烷化剂的预处理方案,在进行异基因 HSCT 的患者中限制 INO 的累积剂量为2.7-3.6 mg/m2,在首次出现肝功能不全体征时使用大剂量类固醇,以及延长INO 末次给药与HSCT的时间。所有接受 INO 的患者均应考虑使用熊去氧胆酸预防(300mg 每日3次),但去纤维蛋白多核苷酸作为预防并无明确作用,即使是对于高危患者。
INO治疗复发性/难治性 ALL的联合方案
虽然单药 INO 治疗是R/R ALL 患者的重大进步,但当作为单药治疗给药时大多数患者无法治愈,<20%的患者长期生存。因此,很多研究集中于 INO 联合化疗和/或其他新型药物(如贝林妥欧单抗),旨在加深缓解并进一步改善生存结局(表2)。
MD 安德森癌症中心在R/R Ph 阴性 B -ALL 患者中研究了mini-hyper-CVD(减量超分割环磷酰胺、长春新碱和地塞米松交替减量甲氨蝶呤和阿糖胞苷)联合 INO 的方案。图2显示了该方案在过去十年中的演变情况。INO最初在第1-4周期的第3天给药,第1周期剂量为1.8 mg/m2,第2-4周期剂量为1.3 mg/m2(累积剂量为5.7 mg/m2),后来降至第1周期1.3 mg/m2,第2-4周期1 mg/m2(累积剂量为4.3 mg/m2),以降低 SOS/VOD 风险(图2A)。在59例接受治疗的患者中,总缓解率为78%,82%的缓解者达到 MRD 阴性(流式细胞术)。
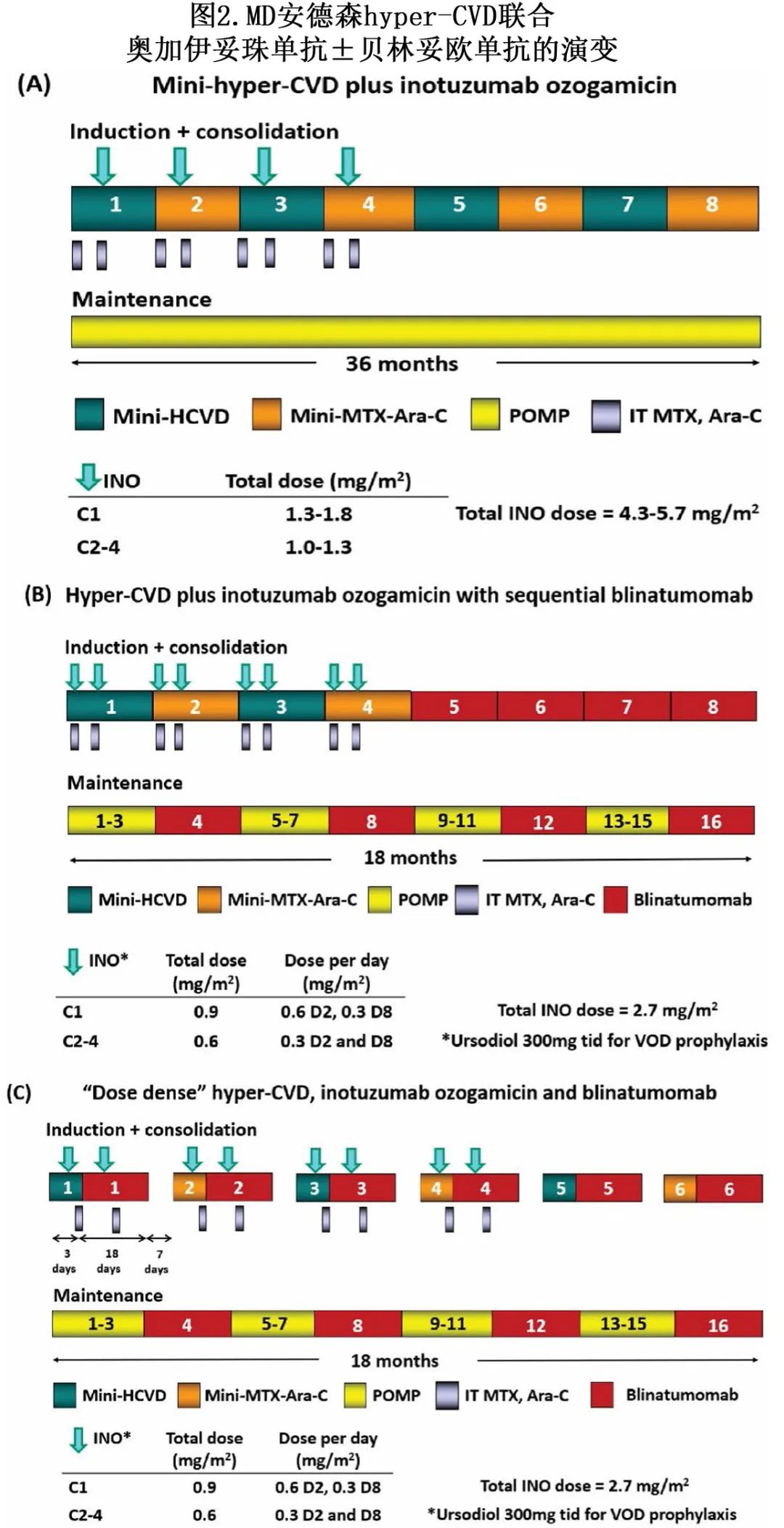
首次挽救治疗的缓解率尤其令人鼓舞,总缓解率为91%。使用该单次给药方案的 SOS/VOD 发生率为15%,与使用相似给药策略的初始 II 期研究的17%相似。中位 OS 为11个月,1年 OS 率为46%。将生存结局与 INO 单药治疗的历史数据进行比较,表明联合治疗优于 INO 单药治疗。
然后对该研究进行修订,以进一步降低和分割 INO 剂量、增加贝林妥欧单抗,以及强制要求熊去氧胆酸预防 (图2B)。这些变更的目的有两个:通过增加贝林妥欧单抗来加深缓解,通过减少 INO 的剂量和增加末次INO给药与异基因HSCT之间的间隔来降低 SOS/VOD 风险。在这种新设计中,患者接受4个周期的 mini-hyper-CVD联合INO,随后接受4个周期的贝林妥欧单抗,然后接受POMP(6-巯基嘌呤,长春新碱,甲氨蝶呤和泼尼松)与贝林妥欧单抗交替给药的维持治疗。第1周期第2天 INO 降至0.6 mg/m2,第8天降至0.3 mg/m2,第2-4周期第2天和第8天降至0.3 mg/m2(累积剂量为2.7 mg/m 2)。在最近发表的 mini-hyper-CVD +INO±贝林妥欧单抗研究中(患者#68+接受blinatumomab),110例患者接受治疗。总缓解率为83%,82%的缓解者达到 MRD 阴性(流式细胞术)。中位 OS 为17个月,3年 OS 率为40%。首次挽救治疗的患者结局最佳,中位 OS 为31个月,3年 OS 率为49%。在界标分析中,接受后续异基因 HSCT 无获益(两组的3年 OS 均为54%)。在对 INO 减量和分次给药以及添加贝林妥欧单抗后,SOS/VOD 率也降低(2% vs.先前设计的13%;P=0.05)。这些数据证实,使用较低剂量的 INO 可显著缓解SOS/VOD,且不会损害疗效。
mini-hyper-CVD +INO+ 贝林妥欧单抗现在又进一步进行修订,从第1周期开始给予所有药物(图2C)。在最新的设计中,给予未移植患者6个周期的“剂量密集”mini-hyper-CVD+INO+贝林妥欧单抗,随后POMP/贝林妥欧单抗维持治疗。在每个周期中,在第4天开始贝林妥欧单抗治疗(即hyper-CVD 化疗开始后)并持续至每个周期的第21天,随后停药7天,然后开始下一个周期。已有15例R/R ALL 患者接受该方案治疗,所有患者均缓解,92%的患者达到 MRD 阴性(1个周期后为77%)。在一项纳入新诊断和复发/难治性患者的的回顾性分析中也观察到该方案的早期缓解率较高。在新诊断或 MRD 阳性 ALL 患者中,10/11例 (91%) 患者实现 MRD 阴性(10-6,二代测序),该终点与 ALL 结局更佳相关。剂量密集mini-hyper-CVD、INO和贝林妥欧单抗方案的深度和快速 MRD 阴性反应令人鼓舞,目前也在新诊断B-ALL 老年患者中评价该方案。
INO治疗新诊断ALL的联合方案
老年患者
多项研究也在评价 INO 在新诊断ALL患者中的应用,且多集中于老年患者,老年患者对常规化疗的耐受性较差,历史长期 OS 率仅为20%。探索 INO 作为一线治疗的进行中的研究见表3,INO为基础方案治疗老年 ALL 患者中的可用研究数据见表4。
MD 安德森癌症中心还在新诊断≥60岁 Ph 阴性 B-ALL 患者中研究了上述相同的mini-hyper-CVD +INO 方案。最初52例患者接受治疗,中位年龄为68岁。总缓解率为98%,96%的患者达到 MRD 阴性(流式细胞术)。高缓解率转化为长期生存,3年无进展生存期 (PFS) 和 OS 率分别为49%和56%。与复发性/难治性患者的研究一样,后来对该方案进行了修订,使用较低的分次 INO 剂量(累积剂量2.7mg/m2),加用贝林妥欧单抗并强制进行熊去氧胆酸预防。共80例老年患者接受mini-hyper-CVD+INO±贝林妥欧单抗治疗(#50+接受更新方案治疗)。12例患者 (15%) 复发,5年 PFS 和 OS 率分别为44%和46%。该结局优于单独使用化疗时约20%的历史5年 OS 率。一项倾向评分分析证实,在相似的老年人群中,mini-hyper-CVD +INO+贝林妥欧单抗方案与剂量降低的 hyper-CVAD 相比具有优效性。
尽管与历史预期相比有所改善,但该方案的毒性仍是主要问题。总体而言,35例患者 (44%) 在缓解期死亡(包括9例因MDS或AML、8例因感染和5例因SOS/VOD)。≥70岁患者中缓解期死亡风险更高(占缓解期死亡的85%),导致生存结局呈年龄依赖性(60-64、65-69和≥70岁患者的中位 OS 分别为75个月、47个月和35个月)。由于与化疗相关的特定风险(例如继发性骨髓恶性肿瘤和感染),≥70岁患者现在仅接受 INO 和贝林妥欧单抗治疗,而不接受 mini-hyper-CVD 骨干治疗。Alliance A041703 研究评价了类似方案,≥60岁新诊断 Ph 阴性 B-ALL 患者在第1周期接受1.8 mg/m2分次 INO 诱导治疗,在第2周期接受1.5 mg/m 2分次 INO 诱导治疗,之后贝林妥欧单抗巩固治疗4-5个周期。在接受治疗的33例患者中,总缓解率为96%(INO诱导后为85%),1年 OS 率为84%。还需要更长期的随访来确认缓解持久性。
其他多种INO为基础的一线治疗方案正在新诊断 ALL 的老年人中评价。在 INITIAL-1 研究中,>55岁新诊断的Ph 阴性 B- ALL 患者接受3个周期地塞米松+INO诱导治疗(第1周期为1.8 mg/m2,第2-3周期1.5 mg/m2),之后接受6个周期年龄调整的化疗作为巩固/维持治疗。43例患者接受治疗,中位年龄为64岁。3个周期 INO 诱导治疗后所有患者均达到CR/CRi,71%的患者达到 MRD 阴性(10-4)。3年无事件生存率 (EFS) 和 OS 率分别为55%和73%,仅有1例非致死性SOS/VOD。EWALL-INO研究也入组相似患者,给予2个周期诱导治疗,包括INO、长春新碱和地塞米松(诱导1)及INO、环磷酰胺和地塞米松(诱导2),随后6个周期的年龄调整巩固治疗,然后 POMP 维持治疗。131例患者接受治疗,2个诱导周期后的 CR/CRi 率为90%,2年 OS 率为54%。
综上所述,INO为基础的一线治疗在老年 B-ALL 患者中安全有效。Alliance A042001建立在 MD 安德森mini-hyper-CVD 和 INO 方案的良好经验基础上,是一项在新诊断老年(≥50岁)B-ALL中评价mini-hyper-CVD 联合 INO对比剂量调整 hyper-CVAD 的随机 II 期研究。目前尚无数据,研究正在进行中。
年轻成人
在新诊断年轻成人 ALL中也正在探索INO 联合方案。MD 安德森开发了 hyper-CVAD联合贝林妥欧单抗的方案,现在已经修订并增加INO。hyper-CVAD+贝林妥欧单抗方案包括4个周期的hyper-CVAD,然后4个周期贝林妥欧单抗,然后是 POMP 和贝林妥欧单抗维持治疗。接受治疗的前38例患者均缓解,97%为 MRD 阴性(流式细胞术),3年无复发生存率 (RFS) 和 OS 率分别高达73%和81%。另外37例患者目前已接受该方案联合INO 治疗(第2、4、6和8周期第1天和第8天给药0.3mg/m2;累积剂量为2.4 mg/m2)。中位随访22个月仅3例复发,2年 RFS 和 OS 率分别为88%和100%。加用 INO 的初始数据令人鼓舞,表明在新诊断 Ph 阴性年轻 B-ALL 患者中常规使用 INO 具有获益。
值得注意的是,Alliance A041501是一项随机研究,也评价了 INO 联合标准化疗治疗新诊断 B-ALL。由于联合治疗方案存在毒性问题,可能与该方案中使用多种肝毒性药物(例如 INO 和门冬酰胺酶)相关,因此研究暂停。该研究的失败强调了需要与 INO 进行合理联合治疗,并避免重叠毒性。
INO在ALL中的其他试验性应用
INO用于MRD阳性患者
在 INO-VATE 研究中,INO与缓解者中63%的 MRD 阴性率相关,并为 INO 治疗 MRD 阳性 B-ALL 的研究提供支持。一项 II 期研究入组26例 MRD 阳性 ALL 患者,并在第1周期第1天和第8天分别接受0.6 mg/m2和0.3 mg/m2剂量的 INO 治疗,以及在2-6周期第1天和第8天接受0.3 mg/m2剂量的 INO 治疗。16例 (62%)患者为Ph 阳性ALL,同时接受了BCR::ABL1 TKI治疗(主要是ponatinib)。MRD(10-4)阴性缓解率为69%,2年 OS 率为60%。GIMEMA 另一项研究在20例 MRD 阳性 B-ALL 患者中评价了INO。20例患者中的11例 (55%) 达到 MRD 缓解(<10-4)。这些令人鼓舞的数据支持进一步评价 INO 作为 ALL 的 MRD 驱动治疗,也支持在一线环境中继续评价 INO,以诱导深度MRD阴性缓解。
INO用于Ph+ ALL
INO 在R/R Ph+ ALL 中有效,CR/CRi率为73%,中位 OS 为8.7个月,与 INO-VATE 研究更广泛人群相似。在一项 I/II 期研究中,INO联合bosutinib治疗未携带 T315I 突变的R/R Ph+ ALL 患者。在18例患者(16例 Ph+ ALL 和2例 CML 加速期患者)中,CR/CRi率为83%,其中56%获得完全分子学缓解。中位 OS 为13.5个月,似乎优于 INO 单药治疗。
INO作为移植后维持治疗
一项I 期研究纳入CD22+ ALL和复发高风险患者评估INO作为移植后维持治疗。INO剂量为0.3 mg/m2至0.6 mg/m2,每周期给药一次,最多12个周期。MTD为0.6 mg/m2。18例接受治疗的患者中未观察到 SOS/VOD。中位随访18.1个月,仅观察到2例复发,1年 PFS 和 OS 率分别为89%和94%。该研究表明,低剂量 INO 可以在围移植期安全给药,也有助于预防高危患者复发。
INO与CAR-T细胞治疗排序
在临床实践中,通常是在 CAR-T 细胞治疗前给予INO,作为挽救治疗方案和桥接治疗。然而,关于既往 INO 暴露是否影响 CAR-T疗效的数据不一。一些儿童研究表明,与历史预期相比,既往INO(包括 INO 作为桥接治疗)不影响 tisagenlecleucel 给药后的缓解率或长期结局。但在成人患者的 brexucabtagene autoleucel ZUMA-3 研究中,既往有 INO 暴露的患者的 CR/CRi 率(既往接受过 INO 暴露为59% vs既往未接受过 INO 暴露为77%)和OS(中位 OS 分别为8.8个月和47.0个月)数值较低。未来的研究还需要评价 INO 与其他可用治疗(包括贝林妥欧单抗和 CD19 CAR-T)的最佳排序,以及在 CAR-T前使用 INO 作为桥接治疗。
总结
在过去十年中,INO与贝林妥欧单抗和 CAR-T 细胞共同改善了成人 ALL的结局。虽然已证明 INO 比传统细胞毒化疗在治疗复发性/难治性 B 细胞ALL中更有效,但其最大的潜力在于在一线治疗和挽救治疗中作为联合治疗。INO联合低剂量化疗和贝林妥欧单抗用于复发/难治性 ALL 时,3年 OS 率>50%,即使在未移植患者中也是如此。同样,在新诊断 B 细胞 ALL 患者中,无论是否与化疗、贝林妥欧单抗或两者联用,均观察到 INO 治疗后非常好的结果。在这些研究过程中,也对 INO 剂量进行了修改,有研究表明,较低的分次 INO 剂量可能非常有效,也可降低 SOS/VOD 风险。研究也在持续扩展 INO 的潜在应用,包括用于 MRD 阳性患者、联合BCR::ABL1酪氨酸激酶抑制剂,以及低剂量作为移植后维持治疗。其中许多进行中的研究也探索了 INO 的替代给药策略。新的转化研究也在探索INO的耐药机制,可能有助于为未来合理的药物组合提供信息。FDA于2017年批准INO,该里程碑为这些重要研究铺平道路,但这只是INO临床开发的一小步。INOVATE研究之后几年的研究强调了肿瘤学的一个真理:药物的获批,通常只是其真正临床开发和创新的开始。
参考文献
Short, N.J., Jabbour, E., Jain, N. et al. Inotuzumab ozogamicin for the treatment of adult acute lymphoblastic leukemia: past progress, current research and future directions. J Hematol Oncol 17, 32 (2024). https://doi.org/10.1186/s13045-024-01552-7
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















新药,白血病患者的新希望
5
#急性淋巴细胞白血病# #ALL# #奥加伊妥珠单抗#
7