【ASH继续教育】功能性高危多发性骨髓瘤的特征和治疗
2023-12-20 聊聊血液 聊聊血液 发表于上海
在2023年ASH继续教育项目的一篇综述中,作者探索了功能性高危患者的主要特征、可用的已知风险因素和评分系统以及可能的治疗手段。
功能性高危MM
多发性骨髓瘤(MM)是一种临床和生物学高度异质性的疾病,总生存期可介于接受强化化疗的标危患者的十多年到具有高危特征的患者的2-3年。目前的分期系统依赖于基线生物学风险因素,将患者分为具有不同进展或死亡风险的亚组,但有时在识别高危患者方面表现不佳,尤其是考虑到功能性高危患者时;功能性高危患者不一定表现出基线高危特征,但通常对诱导治疗反应不佳或治疗开始后早期复发,即使在新药治疗下患者的生存率也特别低。该亚组患者的迅速识别、一致定义及其管理目前存在未满足的医疗需求。
在2023年ASH继续教育项目的一篇综述中,作者探索了功能性高危患者的主要特征、可用的已知风险因素和评分系统以及可能的治疗手段。

学习目的
识别功能性高危多发性骨髓瘤患者
为功能性高危多发性骨髓瘤患者制定可能的治疗策略
定义疗效不佳和早期复发的可能风险因素
临床案例
1例58岁男性新诊断 (ND)MM患者,ISS I期,R-ISS II 期,IgGκ。有骨病变症状(L3椎骨骨折),磁共振成像显示骨旁浆细胞瘤,累及左右椎弓根。骨髓活检示浆细胞浸润30%,骨髓穿刺FISH分析del(17p)、t(4;14)、t(14;16) 和1号染色体异常均为阴性。患者无合并症,ECOG PS为1,与骨病相关。
患者接受4个周期的达雷妥尤单抗、硼替佐米、沙利度胺和地塞米松 (DVTd) 治疗,在第1周期后达到部分缓解 (PR),但在后续周期中M蛋白未显著减少。诱导期后,患者接受干细胞动员和采集以及大剂量美法仑和自体干细胞移植 (HDM-ASCT),M蛋白未进一步降低。ASCT 后2个月观察到 M 蛋白突然增加,同时发生高钙血症。对复发时的骨髓浆细胞进行 FISH 分析,结果显示获得del(17p)。开始卡非佐米、来那度胺和地塞米松 (KRd) 二线治疗。患者达到非常好的部分缓解 (VGPR),且治疗开始后24个月维持VGPR。
如何定义高危MM?
在过去20年中,由于引入新药及其联合方案及使用HDM-ASCT,MM的预后得到了极大改善。单MM的生物学和临床多样性反映到其临床过程和预后的异质性;因此,NDMM患者的总生存期 (OS) 可介于2-3年(存在高危特征)至超过10年(标危)。
部分生物学和临床风险因素与侵袭性疾病相关,已开发相关风险模型用于预测复发或死亡的风险。高β2微球蛋白(B2M,肿瘤负荷和肾功能不全的标志物)、高乳酸脱氢酶 (LDH)(与浆细胞增殖相关)和低白蛋白(反映全身性炎症)是与疾病侵袭性相关的风险因素。
FISH可检测常见染色体异常,包括t(4;14)、t(14;16) 和del(17p),它们在诊断时在高达15%-20%的 MM 患者中检测到,其存在与较短的无进展生存期 (PFS) 和 OS 相关。1号染色体长臂 (1q) 的拷贝数改变,诊断时在高达30%的患者中可检测到,预示着更差的生存期。Del(1p32) 也是不良特征。高危染色体异常的数量或并发突变(如 TP53 失活)同样是预后因素,因为所谓的双打击或超高危骨髓瘤(≥2个高危基因异常)患者比1个或0个高危基因异常患者生存结果更差。除细胞遗传学外,不同的基因表达谱 (GEP) 签名(signature)也是 PFS 和 OS 的独立预后因素,是识别高危的额外方法。骨髓瘤细胞在髓外扩散是另一个不良预后因素。髓外浆细胞瘤也是 PFS 和 OS 的风险因素。多个研究小组已经证明,即使不符合浆细胞白血病标准,循环肿瘤细胞 (CTC) 也与生存期缩短相关。此外,通过转录组谱鉴定的具有浆细胞白血病样状态的 MM 表现出侵袭性病程。
国际骨髓瘤工作组目前推荐的风险分层模型为R-ISS,将患者分为3个不同 OS 的风险组(I期:未达到 [NR];II期:83个月;III期:43个月);但大多数患者 (62%) 属于中危。为了解释这个问题,同时也包括染色体 1q异常,欧洲骨髓瘤网络最近提出了 R-ISS的第二次修订(R2-ISS),将患者分为4个风险类别,其具有更均一的再分配(表1)。
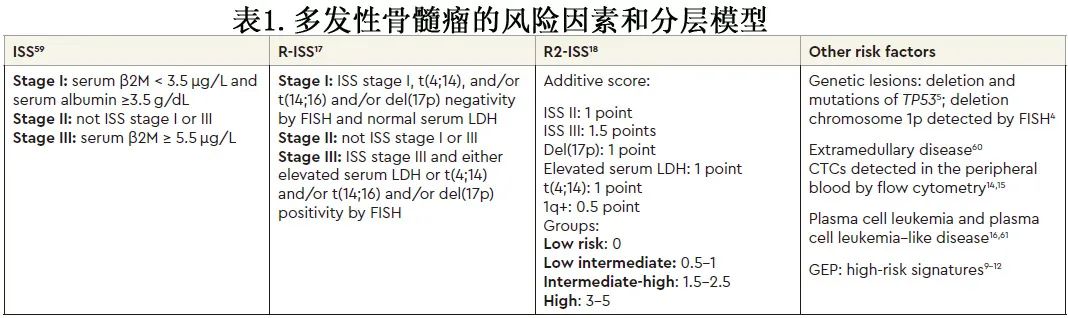
什么是功能性高危?
尽管基线风险分层已有所改善,但在诊断时未归类为高危的患者中,仍有相当大比例的患者即使接受最佳初始治疗也会在治疗开始后12-18个月内进展,这些患者视为功能性高危 (FHR) 患者。关注早期复发及其相关风险特征的研究具有一定的异质性,其中包括适合移植和不适合移植的患者,大多数接受免疫调节剂 (IMiD) 和蛋白酶体抑制剂 (PI) 一线治疗,而抗 CD38 单抗(MoAb) 一线治疗的数据较缺乏。早期复发通常定义为初始治疗后12至18个月内复发,也有个别报告中为24个月。发生早期复发的患者的 OS 较短,范围为18-32-44个月(表2)。

与较老的治疗方案相比,一线纳入抗 CD38 MoAb 的新型方案可显著降低12-24个月时的早期复发风险,适合移植和不适合移植患者的早期复发风险分别降至约10%和20%以下。基于这些积极结果,为这些高危人群设计特定的临床试验变得更具挑战性。该病例便是 FHR MM 患者:尽管缺乏基线高危特征,但疾病早期复发(初诊后12个月),表明临床病程具有侵袭性。
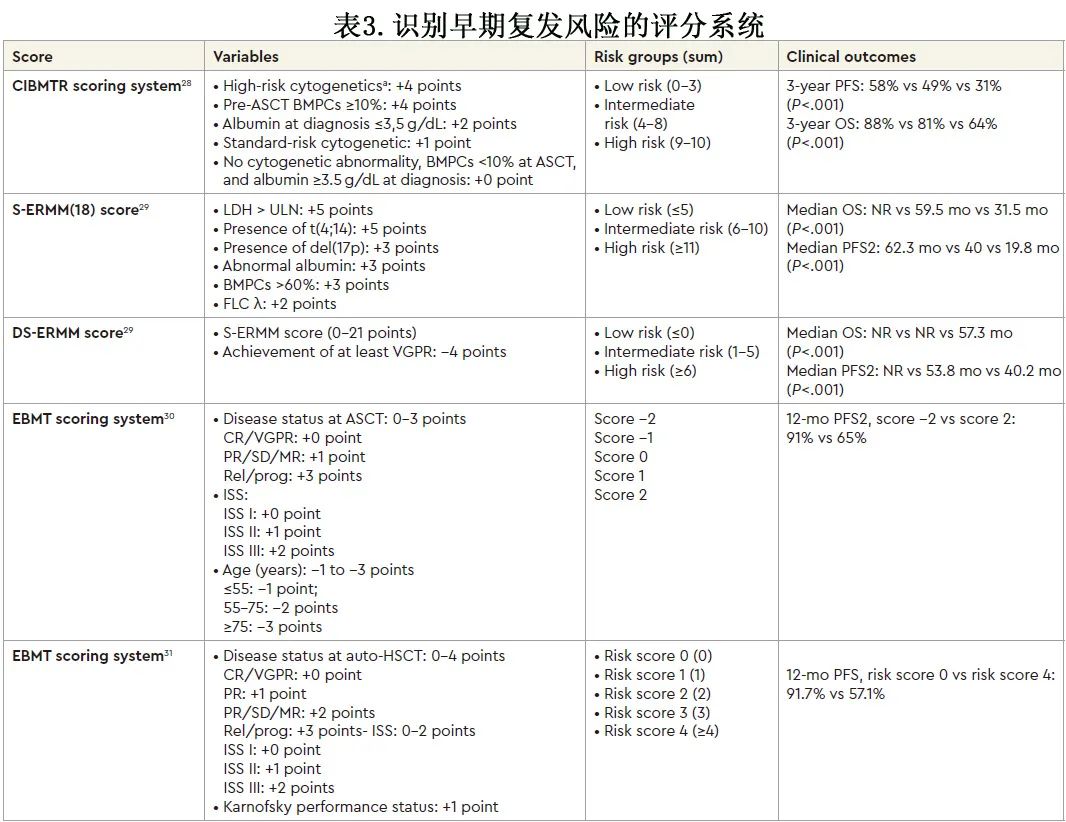
如何识别早期FHR?
已有多个工作组致力于确定早期复发的风险因素,并将其纳入评分系统(表2和表3)。早期复发的患者中存在高肿瘤负荷和器官损伤标志物(贫血、血小板减少、高浆细胞浸润、高钙血症、肾功能不全、高LDH)、晚期骨髓瘤分期(Durie和 Salmon III 期、ISS III期、R-ISS III期)和高危细胞遗传学特征。然而也有部分“标危”患者早期复发,例如,22%的早期复发患者为ISS-I,12%-28%为标危细胞遗传学。不同研究在分析的基线特征方面具有异质性,只有最近报告一项研究纳入更全面的评价,包括R-ISS、扩展细胞遗传学评价(1q和 1p 异常)和突变状态(p53、IGLL5突变、白细胞介素 6/JaK/STAT3 通路)。事实上,由于 GEP 和 CTC可以补充和完善常见风险因素提供的预后信息,而在社区环境中缺乏获得此类工具可能限制在诊断时正确识别高危患者的能力,将其整合入临床实践中可以更精确地识别早期复发高危患者,尽管仍有部分 FHR 患者可能仅因疾病进展而被识别。然而,早期复发是由于治疗诱导的克隆选择导致早期出现高度耐药的 MM 克隆,还是仅仅是由于基线时风险评价不充分,仍有待确定。
许多报告均强调治疗缓解作为动态因素对生存期的潜在影响,尤其是在考虑微小残留病 (MRD) 阴性时,但关注早期复发风险的研究大多缺乏 MRD 数据;在这些研究中,早期复发患者实现次优缓解(例如<VGPR)的频率更高(相对于当前的CD38单抗方案)。同样,一项针对2190例患者的大型META分析显示,将获得的缓解(≥VGPR vs <VGPR)纳入基线风险评分可改变56%患者的风险状态,早期复发风险患者的比例从7%增加至20%。
在当今的临床实践中,达到≥VGPR 是可接受的早期动态预后因素,可在大多数接受当前治疗的患者中实现。与 VGPR 相比,MRD状态是更好的结局预测因子,可能取代当前的应答系统,并在不久的将来成为早期复发的动态预测因子。在这方面,影像学技术(例如PET/CT)的结合可作为骨髓 MRD 检测的补充,并且在高危患者(高危患者更常见髓外病变)中可能特别重要,而持续 MRD 阴性可在调节早期复发风险中发挥关键作用,从而影响标危的治疗策略(更重要的是,影响高危患者)。
如何治疗FHR患者?
FHR 患者目前代表未满足的医疗需求。一般而言,对于高危患者,通常建议在耐受时进行一线多药化疗、单次或串联移植以及单药或双药维持治疗。应限制无治疗间隔,因为该疾病可能对治疗有反应,但会迅速复发,尤其是在治疗中断或剂量递减的情况下。MASTER研究显示,即使达到 MRD 阴性,极高危患者的治疗中断也会导致 MRD 复发和次优 PFS 的风险升高。此外,FORTE 研究的事后分析显示,与来那度胺单药相比,双药维持治疗(卡非佐米-来那度胺)可降低 MRD 复发的风险,但仅在双药治疗期间如此,因为停用卡非佐米后的风险等于接受来那度胺单药治疗的患者,且在高危患者中尤为明显。
由于 FHR 目前由复发模式定义,因此必须进行具体考虑。首先,治疗期间或停止治疗后不久进展意味着对该治疗难治;早期复发组中难治性患者的比例较高。临床案例中的患者在 HDM 后2个月和 DVTd 后6个月内复发,意味着他是 HDM 难治,且在 DVTd 后缓解持续时间欠佳,不应使用相同的药物进行再治疗。一项分析克隆演变模式的研究表明,对治疗的缓解深度是演变模式的主要决定因素:治疗早期复发或缓解欠佳的患者大多呈现线性克隆演变模式,而达到深度治疗缓解(完全缓解 [CR] 或 MRD 阴性状态)的患者更可能遵循分支演变模式。这些数据提供依据,即在一线治疗缓解不佳的患者中研究强化策略,或考虑将类药物转换为具有不同靶点和作用机制的挽救治疗。
每例患者的最佳联合给药应基于多个因素,包括既往治疗方案的难治性、预期耐受性和药物可用性。
可根据随机临床试验的事后分析考虑FHR的治疗,这些随机临床试验已确立了复发背景下的现行标准治疗(表4),且其中许多试验分析了早期与晚期复发患者的结局。首先,目前推荐作为挽救治疗的3药方案中大多数也对早期复发患者有效,可持续改善 CR 和 MRD 阴性率并延长PFS。例如 POLLUX 研究中,早期复发患者的中位 PFS 从Rd的12个月增加至DRd的37个月;在 ASPIRE 研究中,治疗开始后12个月内疾病进展的患者,KRd使中位 PFS 从Rd的11个月延长至21个月。对于DRd 或卡非佐米 (KRd) 均不耐药的来那度胺初治患者,这些方案均可视为有价值的选择。其他证实早期复发患者中三药方案更优的研究包括,CANDOR 研究中达雷妥尤单抗、卡非佐米和地塞米松(DKd)对比Kd(风险比 [HR]=0.6,中位PFS NR对比Kd的23个月),及IKEMA研究中isatuximab、卡非佐米和地塞米松(IsaKd)对比Kd(HR=0.6,中位 PFS 为25个月对比Kd 的17个月)。根据上述结果,对于既往接受3药方案治疗后早期复发且非达雷妥尤单抗难治的患者,如果来那度胺难治,可选择抗 CD38 MoAb 为基础的三联挽救治疗,包括联合来那度胺 (DRd) 或卡非佐米 (DKd,IsaKd)。而达雷妥尤单抗难治性早期复发患者的治疗选择有限,一般而言,在首次和二次复发时,蛋白酶体抑制剂(硼替佐米或卡非佐米)联合泊马度胺(泊马度胺-硼替佐米-地塞米松 [PVd]、卡非佐米-泊马度胺-地塞米松 [KPd])或烷化剂(卡非佐米-环磷酰胺-地塞米松 [KCd]/硼替佐米-环磷酰胺-地塞米松[VCd])的3药联合是可行的治疗选择,尽管目前缺乏关于这些联合方案早期复发的疗效数据。同样,泊马度胺为基础的治疗方案联合靶向 SLAMF7 的 MoAb elotuzumab 也可视为三线治疗。
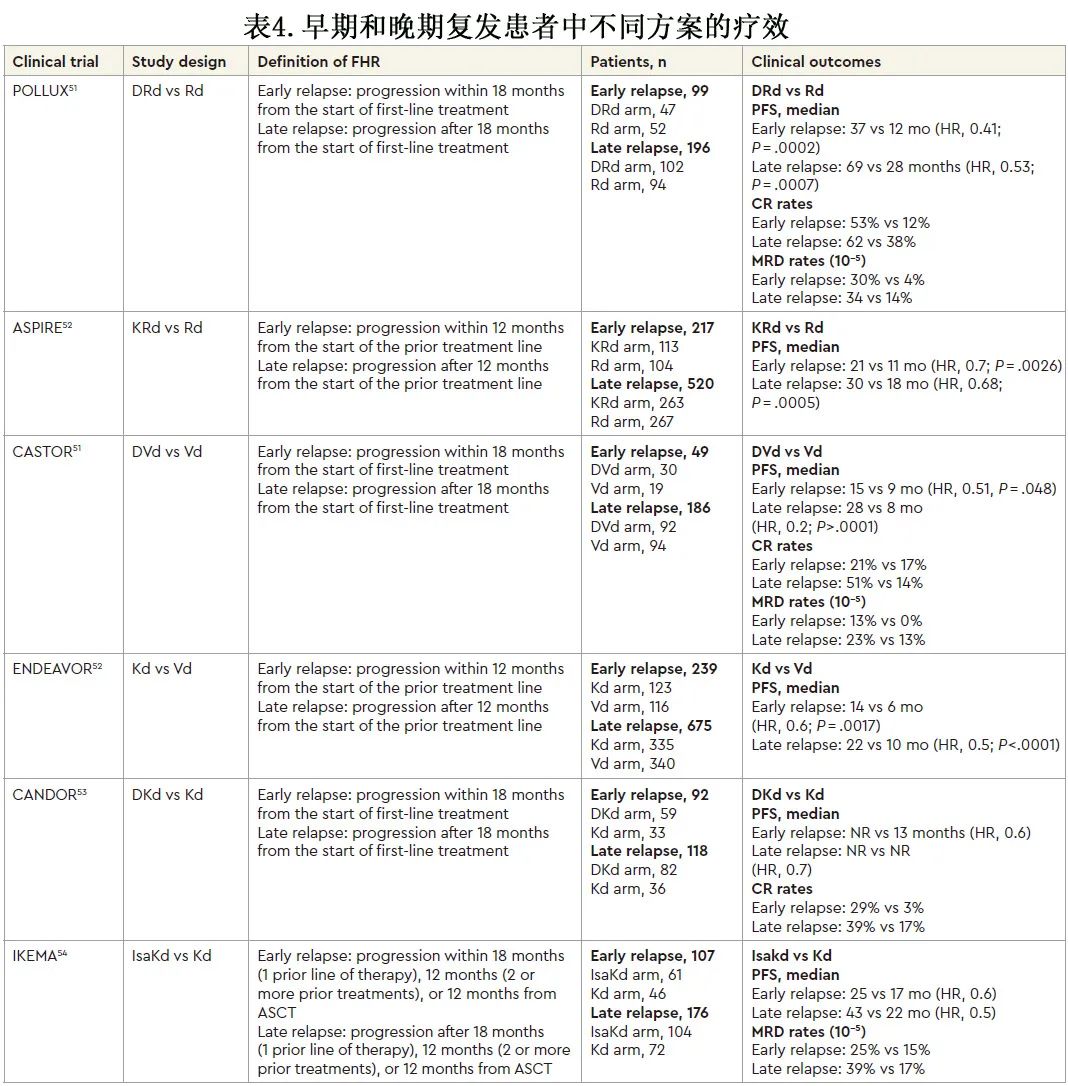
尽管上述方案在早期复发患者中证实疗效,但该人群的生存结局仍显著劣于晚期复发患者。此外,由于目前许多早期复发的患者对达雷妥尤单抗和/或来那度胺也耐药(由于两种药物均已成为诱导和维持治疗策略的主要药物),因此复发时的治疗面临重要挑战。有鉴于此,新的挽救药物(如CAR-T 细胞和双特异性抗体)具有不同的靶点和作用机制,可作为有吸引力的选择(表5)。在 KarMMa-2 研究的队列 2a 中,idecabtagene vicleucel(ide-cel) (BCMA CAR-T 细胞疗法)正在研究作为接受 ASCT 且早期复发患者的挽救治疗(89%的患者在 ASCT 后12个月内进展)。Ide-cel 的总缓解率为84%,46%的患者达到≥CR,几乎是该患者人群一线治疗 (24%) 的两倍。虽然总体患者队列报告的中位 PFS 仅为11.4个月,但在达到 CR/sCR 的患者缓解持续时间更长(24个月),因此,一方面强调了治疗这一功能性高危人群的挑战,另一方面强调了缓解深度的重要性。在初始治疗或 ASCT 后12个月内复发的患者中进行了一项类似的 II 期研究(CARTITUDE-2,队列B),另一种获批的 BCMA CAR T 细胞 ciltacabtagene autoleucel(cilta-cel) 的≥CR率为89%,其中75%为 MRD 阴性(二代测序,10-5);18个月 PFS 为83%,已经超过大多数患者首次缓解的持续时间。

鉴于 T 细胞重定向治疗在早期复发和侵袭性患者中也取得了可喜的结果,应尽量为该高危人群提供双特异性抗体和 CAR-T 细胞;然而,目前双特异性抗体和 CAR T 细胞的适应症仅限于三线或四线治疗后,而非基于药物类别得难治性,这是明显的局限性。更令人感兴趣的是建立一线治疗缓解深度与早期复发风险之间的相关性,从而致力于一线治疗缓解不佳患者早期改变治疗方案,并导致了在 ASCT 后 <VGPR 的 NDMM 患者中研究使用 ide-cel 的治疗强化策略。31例接受治疗的患者的初步结果显示了有希望的疗效:74%的患者达到≥CR,总体人群中MRD阴性(二代流式,10-5)为42%。总之,这些结果虽然是初步的,但表明 CAR-T 细胞可能是有前景的策略,无论是作为早期复发后的挽救治疗,还是作为移植后缓解欠佳时的治疗强化。正在进行的 III 期研究目前正在研究缓解不佳患者的强化治疗。
最后,应考虑开始治疗的最佳时机和连续治疗的作用。前瞻性和回顾性研究显示,在生化而非临床复发时接受治疗的患者具有潜在获益。确实,高危患者生化和临床复发之间的时间间隔通常较短,有人可能认为缺乏足够的证据来改变次优缓解的治疗方案,但在出现经证实的血清学复发的首发体征时改变治疗是合理的。持续治疗在一线和复发时均有效,可能表明早期复发时长期治疗具有潜在重要性(包括抗 BCMA 治疗后),并有助于延长缓解持续时间。
总结
FHR 患者代表了未满足的医疗需求,即使是在高效的一线和挽救性多药治疗方案背景下。目前治疗 FHR 患者的挑战包括通过基线和动态风险因素正确识别早期复发风险较高的患者,以及制定策略以预防高危患者的早期复发以及有效的挽救治疗。有鉴于此,使用最有效的一线方案(四药方案而非三药方案)、动态风险分层模型中纳入治疗反应、缓解不佳患者早期治疗强化和复发时的类别药物/转换,以及早期使用新的免疫治疗方法(CAR-T细胞和双特异性抗体)和 MRD 复发或生化复发时的早期治疗,是有希望在临床研究中得到验证的策略。
参考文献
Hematology Am Soc Hematol Educ Program (2023) 2023 (1): 433–442.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#多发性骨髓瘤# #FHR#
33