J Hepatol:IL-10可能是促进结直肠癌肝转移的关键因子
2024-01-22 MedSci原创 MedSci原创 发表于加利福尼亚
肝脏,是结直肠癌、乳腺癌、黑色素瘤等恶性肿瘤最容易发生转移的部位之一。结直肠癌是我国常见的恶性肿瘤,其发病率居恶性肿瘤发病率第4位。肝脏是结直肠癌血行转移最主要的转移靶器官,约50%的结直肠癌患者伴有
肝脏,是结直肠癌、乳腺癌、黑色素瘤等恶性肿瘤最容易发生转移的部位之一。结直肠癌是我国常见的恶性肿瘤,其发病率居恶性肿瘤发病率第4位。肝脏是结直肠癌血行转移最主要的转移靶器官,约50%的结直肠癌患者伴有肝转移,肝转移是导致病人死亡的主要原因。但其机制可能十分复杂。
2022年9月7日,暨南大学的研究团队在 Gut 上发表题为 Novel TCF21high pericyte subpopulation promotes colorectal cancer metastasis by remodelling perivascular matrix 的文章,通过单细胞转录组技术鉴定了13个TPC亚群,并发现一种新的TCF21high的TPC亚群,将其命名为“基质-周细胞”。该群细胞与结直肠癌(colorectal cancer,CRC)患者的肝转移相关,TPCs中的TCF21通过诱导胶原蛋白改变其局部排列,增加血管周围细胞外基质(extracellular matrix,ECM)硬度,建立了血管周围转移性微环境以引发结直肠癌肝转移。机制上,该研究发现ITGA5可通过FAK/PI3K/AKT途径调节甲基化相关蛋白DNMT1的表达,整合素α5缺失会通过减弱TCF21的DNA高甲基化来增加TPC中TCF21的表达[1]。
从miRNA角度,发现高度转移性CRC细胞释放的细胞外囊泡(EVs)中富含miR-181a-5p,该miRNA通过调节CRC细胞和肝星状细胞(HSCs)之间的相互作用及TME的重塑促进肝转移[2]。miR-181a-5p靶向细胞因子信号传导抑制因子3(SOCS3)3’-UTR抑制其表达,激活IL6/STAT3通路,从而激活HSC;活化的HSC通过分泌趋化因子CCL20激活CCL20/CCR6/ERK1/2/Elk-1/miR-181a-5p正反馈回路;血清中miR-181a-5p水平与CRC患者的肝转移呈正相关。当然,还有团队发现脂肪肝中的肝细胞产生的细胞外囊泡(EV)通过miRNA促进致癌的YAP信号和免疫抑制微环境,进而促进结直肠癌肝转移的进展。
2022年8月30日,基础医学院药理学系朱棣团队联合复旦大学附属中山医院许剑民团队,在Cell Reports发表了题为Tumor-infiltrated activated B cells suppress liver metastasis of colorectal cancers的研究论文。通过单细胞测序,发现了B细胞及其亚群在左半、右半结肠癌肝转移中发挥的重要作用及机制。发现活化B细胞可以显著抑制肝转移。同时发现,抑制肿瘤细胞的Wnt和TGFβ信号通路,可以通过SDF-1-CXCR4轴促进活化B细胞的迁移,从而增强活化B细胞的抗肿瘤能力。
当然,还有从B细胞,甲基化等表观调控等角度研究结直肠癌肝转移的机制的。
近日,一篇发表在《肝脏病学杂志》期刊上的文章,揭示细胞因子IL-10促进结直肠癌肝转移的机制[3]。这是从另外角度发现结直肠癌肝转移的可能机制。
汉堡大学埃彭多夫医学中心(UKE)的Anastasios D. Giannou和Samuel Huber等人发现,调节性T细胞分泌的细胞因子IL-10能够上调单核细胞中PD-L1的表达水平,进而减少结直肠癌肝转移过程中的T细胞的浸润以及抗肿瘤免疫功能,从而促进结直肠癌肝转移。

IL-10是免疫调节的关键细胞因子,在不同癌症类型中的作用存在争议。一般认为由于IL-10作为一种免疫抑制细胞因子被广泛接受。在炎症反应方面,IL-10 能通过下调单核细胞表面主要组织相容性复合体II(major histocompatibility complex class Ⅱ, MHC Ⅱ) 的表达,降低其抗原呈递作用,下调T 淋巴细胞活性, 抑制炎性细胞的激活、迁移和粘附;同时,IL-10也能抑制炎症因子的合成与释放。IL-10被认为通过降低肿瘤微环境中的抗肿瘤免疫反应来促进肿瘤免疫逃逸。
在这项研究中,Samuel Huber等人利用结直肠癌小鼠模型以及小鼠衍生的类器官发现,与IL-10正常表达相比,IL-10表达缺陷或者使用抗体阻断IL-10信号可显著减少荷瘤小鼠的肝转移,该效应与结直肠炎症程度无关;而原发肿瘤重量相当。
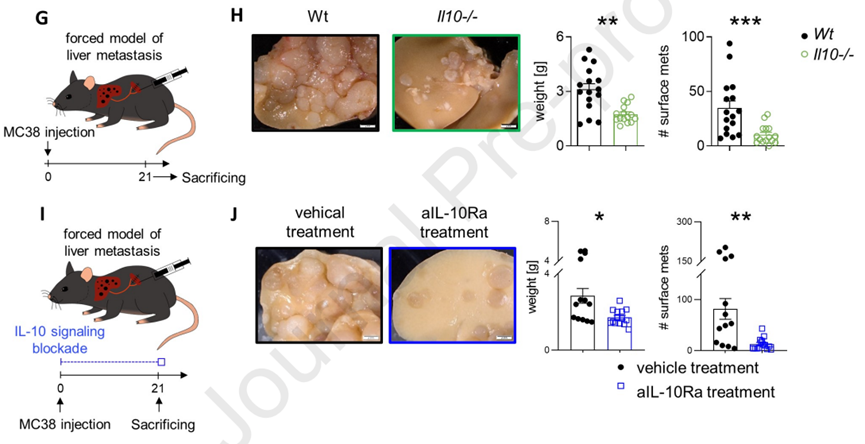
IL-10缺陷或抗体阻断后减少肝转移
结果显示,参与促进结直肠癌肝转移的IL-10,主要由肝脏部位的Foxp3+调节性T细胞(Treg)分泌。肝脏Treg细胞特异性缺失IL-10可以使荷瘤小鼠免于肝转移。
同时,Treg细胞同样是IL-10的主要靶细胞,表达IL-10的受体(IL-10Ra)。IL-10以自分泌的方式作用于Treg细胞,从而扩大IL-10的表达量。
研究者们发现,肝转移过程中,肝脏部位的髓系细胞高表达IL-10Ra,也是IL-10的重要靶细胞。IL-10作用于髓系细胞后,会诱导其免疫检查点蛋白PD-L1表达水平上升,尤其是单核细胞。
从机制上来看,IL-10一方面以自分泌的方式诱导Treg细胞产生更多的IL-10,另一方面作用于髓系细胞使其高表达PD-L1,通过PD-L1/PD-1信号通路抑制CD8+T细胞的抗肿瘤免疫活性,减少其浸润水平。
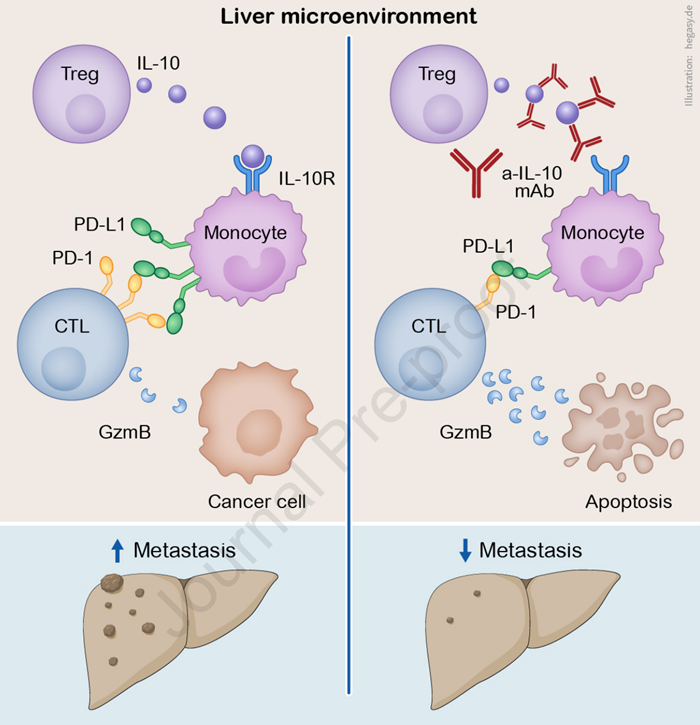
机制图
体外结果显示,相比于其它小鼠,髓系细胞特异性缺失IL-10Ra的肝转移小鼠,其肿瘤浸润CD8+T细胞的颗粒酶B表达水平增加,诱导肿瘤细胞凋亡数量增加。与之结果一致,髓系细胞特异性缺失表达PD-L1的小鼠,肝转移负担显著降低,肿瘤浸润CD8+T细胞数量增多,且表达更多的颗粒酶B。
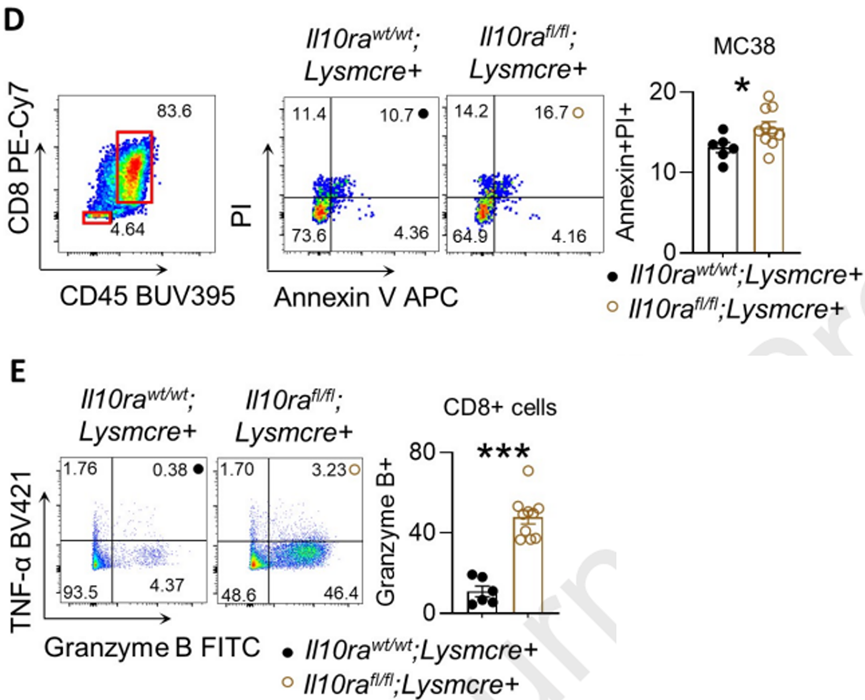
髓系细胞表达缺失IL-10Ra时,T细胞浸润数量和抗肿瘤活性增加
总之,研究人员将IL-10确定为促进肝转移形成的细胞因子,能够调控PD-L1表达水平、抑制T细胞的抗肿瘤免疫。这意味着IL-10或成为未来治疗结直肠癌肝转移的一个重要靶点,抗IL-10Ra与抗PD-L1联合治疗具有潜在价值。事实上,有关IL-10抑制剂的研发,也有大量的潜在的新药,其中也有少数应用于实体瘤方面。
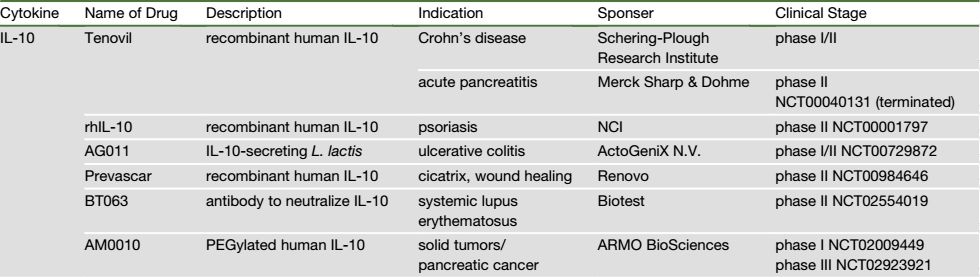
表1 IL-10在研药物临床实验进展情况表
参考文献:
[1] Li X, Pan J, Liu T, Yin W, Miao Q, Zhao Z, Gao Y, Zheng W, Li H, Deng R, Huang D, Qiu S, Zhang Y, Qi Q, Deng L, Huang M, Tang PM, Cao Y, Chen M, Ye W, Zhang D. Novel TCF21high pericyte subpopulation promotes colorectal cancer metastasis by remodelling perivascular matrix. Gut. 2023 Apr;72(4):710-721. doi: 10.1136/gutjnl-2022-327913. Epub 2022 Sep 7. PMID: 36805487; PMCID: PMC10086488.
[2] Zhao, S., Mi, Y., Zheng, B., Wei, P., Gu, Y., Zhang, Z., Xu, Y., Cai, S., Li, X., & Li, D. (2022). Highly-metastatic colorectal cancer cell released miR-181a-5p-rich extracellular vesicles promote liver metastasis by activating hepatic stellate cells and remodeling the tumor microenvironment. Journal of Extracellular Vesicles,11,e12186
[3] Xu et al., Tumor-infiltrated activated B cells suppress liver metastasis of colorectal cancers, Cell Rep . 2022 Aug 30;40(9):111295. doi: 10.1016/j.celrep.2022.111295.
[4]IL-10 dampens antitumor immunity and promotes liver metastasis via PD-L1 induction,J Hepatol . 2023 Dec 29:S0168-8278(23)05369-2. doi: 10.1016/j.jhep.2023.12.015
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#结直肠癌# #结直肠癌肝转移# #IL-10#
29