2018年9月全球批准新药概况(含FDA和NMPA)
2018-11-01 商建丽 药渡
2018年9月,美国食品药品监督管理局(FDA)共批准2个新分子实体(NME)药物,分别是治疗非小细胞肺癌的Dacomitinib(达克替尼)以及治疗小淋巴细胞淋巴瘤、慢性淋巴细胞白血病、滤泡性淋巴瘤的Duvelisib。FDA还首批了4个生物制品,分别是治疗转移性皮肤鳞状细胞癌的Cemiplimab,治疗偏头痛的Galcanezumab和Fremanezumab以及治疗毛细胞白血病的Moxetu
2018年9月,美国食品药品监督管理局(FDA)共批准2个新分子实体(NME)药物,分别是治疗非小细胞肺癌的Dacomitinib(达克替尼)以及治疗小淋巴细胞淋巴瘤、慢性淋巴细胞白血病、滤泡性淋巴瘤的Duvelisib。FDA还首批了4个生物制品,分别是治疗转移性皮肤鳞状细胞癌的Cemiplimab,治疗偏头痛的Galcanezumab和Fremanezumab以及治疗毛细胞白血病的Moxetumomab pasudotox。日本医药品医疗器械综合机构(PMDA)共批准3个新分子实体(NME)药物,分别为治疗急性骨髓性白血病的Gilteritinib、治疗非小细胞肺癌的Lorlatinib以及治疗高眼压症、青光眼的Omidenepag isopropyl,另外还批准了一个治疗2型糖尿病的复方Anagliptin/ Metformin Hydrochloride。中国国家药品监督管理局NMPA(原CFDA)批准1个1类新药,是治疗转移性结直肠癌的呋喹替尼(Fruquintinib)。

1、Cemiplimab

Cemiplimab最初由再生元(Regeneron)开发,之后赛诺菲(Sanofi)获得了该药物在美国以外地区的研发和商业化授权。于2018年9月28日获美国食品药品监督管理局(FDA)批准上市,商品名为Libtayo®,被批准用于治疗转移性皮肤鳞状细胞癌(CSCC)或不能接受治愈性手术或放疗的局部晚期CSCC患者。这是FDA批准的第一例针对晚期CSCC的疗法,同时是第三款获得FDA批准的抗PD-1抗体[1]。
CSCC是美国第二大常见皮肤癌症,最常见的皮肤癌是基底细胞癌。CSCC通常发生在经常暴露于阳光或其他形式的紫外线辐射的皮肤区域。虽然大多数CSCC患者通过手术切除治愈,但是一小部分患者会发展为不再对包括手术和放射在内的局部治疗有反应的晚期疾病。晚期CSCC可能导致肿瘤部位的毁容和局部并发症如出血或感染,或者可能扩散(转移)到局部淋巴结,远处组织和器官并变得危及生命[2]。
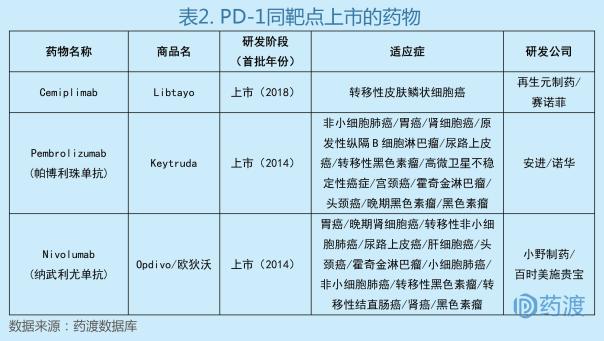
Libtayo®的获批是基于一项开放标签的、多中心的、非随机的临床二期试验(EMPOWER-CSCC-1 (NCT02760498))以及一项开放标签的,非随机的临床一期扩展队列试验(NCT02383212)。共有108名患者(75名患有转移性疾病,33名患有局部晚期疾病)被纳入疗效评估。该研究的主要终点是客观反应率,或治疗后肿瘤部分缩小或完全消失的患者百分比。结果显示,使用Libtayo®治疗的所有患者中有47%的患者肿瘤缩小或消失。这些患者中的大多数在数据分析时具有持续的反应[3]。
Libtayo®是一种针对免疫检查点受体PD-1(程序性细胞死亡蛋白-1)的全人源单克隆抗体,通过阻断PD-1信号通路,它可以帮助人体的免疫系统杀伤肿瘤细胞。它是第一个也是唯一一个专门批准并可用于晚期CSCC的治疗药物。这款药物可用于帮助那些经过外科手术和化学疗法治疗仍未见好转的皮肤癌患者。
2、Galcanezumab

Galcanezumab由礼来公司研发,于2018年9月27日获美国食品药品监督管理局(FDA)批准上市,商品名为Emgality®,被批准用于治疗成人患者偏头痛[4]。
偏头痛是临床上常见的头痛类型之一,以反复发作性的头痛为特点,发作间歇期正常。通常伴有各种自主神经系统症状。偏头痛的病因被认为是环境因素和遗传因素的综合作用所致。世界卫生组织将其列为最致人衰弱的疾病之一。由于荷尔蒙的影响,偏头痛多见于女性,男女患者的比例通常为1:2。首次发病常于10-30岁之间,受到影响的大多数人年龄在35岁和45岁之间。近年来,科学家对偏头痛的机制有了进一步了解,但对具体信号通路和生物标记物的认识尚不充分。降钙素基因相关肽(calcitonin gene-related peptide,CGRP)通路是第一个被研究的药物靶点。CGRP及其受体在与偏头痛病理生理学相关的神经系统区域表达。到目前为止研究表明阻断CGRP通路对于治疗偏头痛是有效的。它与现有的曲坦类(血清素1B/1D激动剂)和阿片类药物的作用机制明显不同[5]。
Emgality®是一种人源化单克隆抗体,靶向于降钙素基因相关肽(CGRP),该受体在偏头痛的发生中发挥了关键作用。CGRP是一种神经肽,已被证明在偏头痛发作时释放,被认为是偏头痛发作的诱因。目前,CGRP受体已成为偏头痛药物研发的热门靶点。
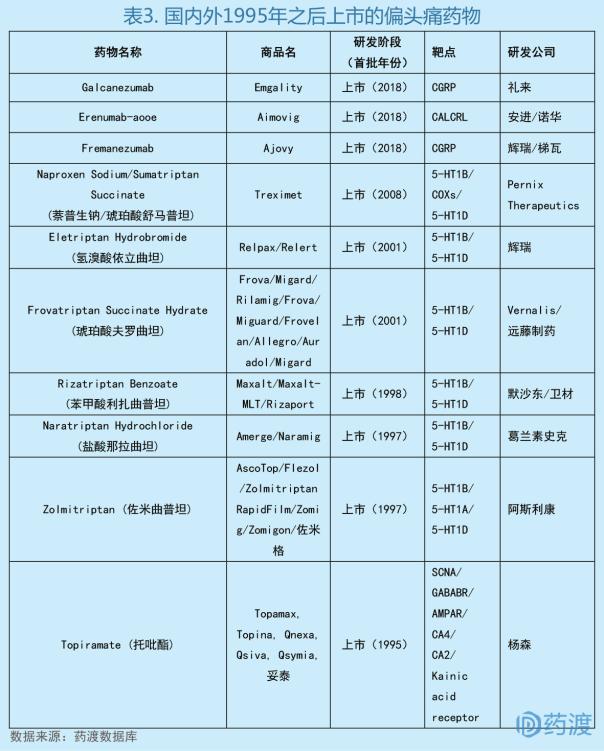
Emgality®的获批,是基于在发作性偏头痛(EM)患者中开展的2项三期临床研究(EVOLVE-1,EVOLVE-2)以及在慢性偏头痛(CM)患者中开展的一项三期临床研究(REGAIN)的数据。在三项研究中,患者随机接受每月一次的安慰剂,初始负荷剂量为240 mg后的Emgality 120 mg或Emgality 240 mg。主要终点是意向治疗研究人群中双盲治疗期间每月MHD数量与基线的平均变化。数据显示,与安慰剂相比,Emgality横跨偏头痛谱在减少每月偏头痛天数方面表现出临床意义和统计学意义的显著疗效[6]。
此次批准,使Emgality®成为继诺华/安进Aimovig® (erenumab-aooe)和梯瓦Ajovy® (fremanezumab-vfrm)之后上市的第3款靶向CGRP的偏头痛药物。用药方面,Aimovig和Emgality均每月一次皮下注射,Ajovy每月一次或每3个月一次皮下注射,将为患者提供一种差异化的治疗选择。
3、Dacomitinib(达克替尼)

Dacomitinib最初由辉瑞研发,2012年授权给SFJ Pharmaceuticals合作开发。于2018年9月27日获美国食品药品管理局(FDA)批准上市,商品名为Vizimpro®,被批准用于治疗携带EGFR基因外显子19缺失或外显子21 L858R置换突变的转移性非小细胞肺癌(NSCLC)患者[7]。
肺癌是世界上最常见的恶性肿瘤之一,已成为我国城市人口恶性肿瘤死亡原因的第一位,并且也是2008年全球范围内男性癌症死亡的一个主要原因。在女性当中,它是第四大最常见被诊断出的癌症和癌症死亡的第二主要原因。非小细胞型肺癌(Non-Small Cell Lung Cancer,NSCLC)是肺癌最常见的组织学类型[8],是除小细胞肺癌(SCLC)之外的其余上皮性肺癌。最常见的NSCLC为鳞状细胞癌、大细胞癌和腺癌,但也有其他发病率较低的类型,所有类型都可以发生少见的种组织学变异[9]。非小细胞肺癌约占所有肺癌的75%,超过三分之二的患者发现时已处于中晚期,5年生存率很低。EGFR是一种帮助细胞生长和分裂的蛋白质。当EGFR基因突变时,它可能导致蛋白质过度活跃,导致癌细胞形成。EGFR突变可能在全球10%至35%的NSCLC肿瘤中发生,并且最常见的激活突变是外显子19和外显子21 L858R取代中的缺失,其共同占已知激活EGFR突变的80%以上。该疾病与低存活率相关,疾病进展仍然是一个挑战[10,11]。
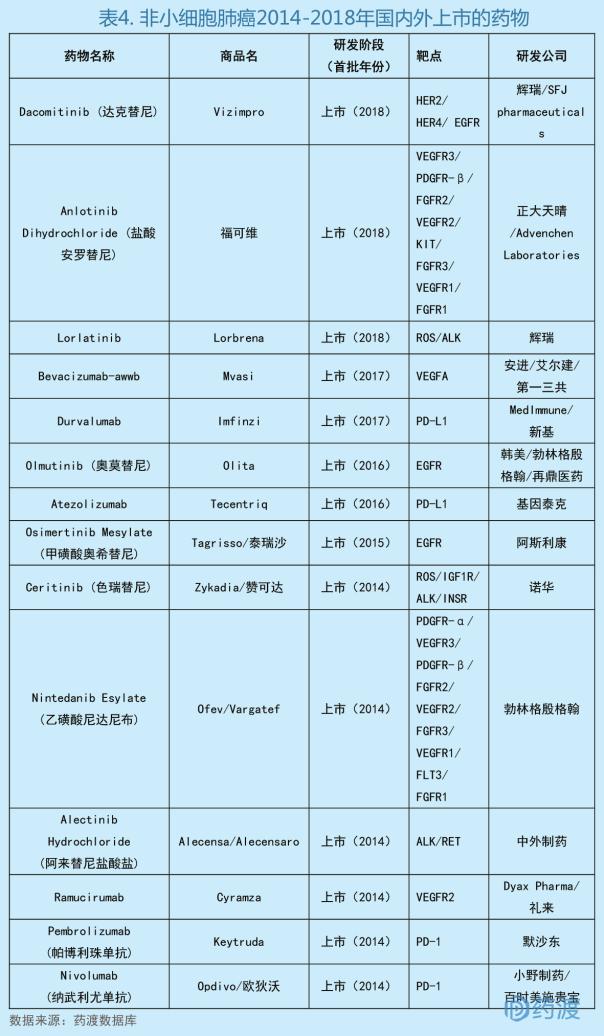
Vizimpro®获批是基于一项名为ARCHER 1050的随机的、多中心的、国际性的、开放标签的临床三期试验的结果。总计452名患者被随机分为两组,接受Vizimpro或者活性对照的治疗。该试验的主要终点为由独立的放射学审查委员会(IRC)评估的无进展生存期(PFS)。根据IRC评估的PFS,Vizimpro与活性对照相比,显著延长了患者的中位PFS(p<0.0001)。Vizimpro治疗组PFS为14.7个月(95% CI: 11.1, 16.6),活性对照组为9.2个月(95% CI: 9.1, 11.0)[12]。
EGFR突变的晚期非小细胞肺癌是一种常见疾病,特别是在亚洲人群中,Vizimpro®的上市为治愈独特性的非小细胞肺癌提供了更多的选择。
4、Duvelisib

Duvelisib于2018年9月24日获美国食品药品监督管理局(FDA)批准上市,由Verastem上市销售,商品名为Copiktra®。Duvelisib最初是由Intellikine(后被武田收购)研发,后Infinity获得了该化合物全球开发和商业化权利。2014年,Infinity与艾伯维达成合作协议联合开发Duveraisib,然而2016年艾伯维终止了与Infinity的合作,Infinity重新获得了duvelisib的全球权利。2016年11月,Infinity授权给Verastem(现为Verastem Oncology)开发和商业化duvelisib的全球独家权利。Copiktra®获批用于治疗至少两次既往治疗后复发或难治性慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)和至少两次既往治疗后复发或难治性滤泡性淋巴瘤(FL)[13]。
CLL/SLL是主要发生在中老年人群的一种成熟B淋巴细胞克隆增殖性肿瘤,以淋巴细胞在外周血、骨髓、脾脏和淋巴结聚集为特征。SLL与CLL是同一种疾病的不同表现。这两种疾病之间的唯一区别是:在CLL中,细胞主要存在于血液和骨髓中;而在SLL中,细胞主要存在于淋巴结中[14]。CLL/SLL的症状包括腹部肿胀,即使仅少量进食也感觉饱腹。其他症状包括疲劳,呼吸短促,贫血,容易瘀伤,盗汗,体重减轻和频繁感染。然而,许多CLL/SLL患者会存活多年而没有症状。虽然目前有治疗方法,但大量患者在治疗后复发,对当前药物难以治疗,或者无法耐受治疗,这代表了重要的医疗需求。额外口服药物的潜力,特别是作为可用于一般社区医生的武器装备的单一疗法,可能对CLL/SLL患者的治疗具有重要价值[15]。
滤泡性淋巴瘤(follicular lymphoma,FL)是最常见的惰性非霍奇金淋巴瘤(non-Hodgkin's lymphoma,NHL),其发病率逐年增高,其遗传标记是t (14;18) (q32;q21)异位,导致BCL2蛋白持续过量表达,损害了正常生发中心的凋亡功能。组织学特征是低倍镜下肿瘤细胞呈现明显的结节状生长。肿瘤性滤泡主要由不同比例的中心细胞和中心母细胞组成,中心细胞的核有裂沟,称为小核裂细胞;中心母细胞体积大,核圆形或分叶状,称为无核裂细胞。FL最常见临床表现是无痛性淋巴结肿大,典型临床表现为多部位淋巴组织侵犯。FL是对化疗和放疗最敏感的恶性肿瘤之一,在早期阶段,主要为放疗,在疾病进展至晚期时,进行化疗或使用免疫治疗[16]。
Duvelisib是PI3K的抑制剂,其抑制活性主要针对PI3Kδ和PI3Kγ亚型。Duvelisib可以抑制恶性B细胞和原发性CLL肿瘤细胞的生长并降低它们的存活率。它还能抑制多种关键细胞信号通路,包括B细胞受体信号转导和CXCR12介导的恶性B细胞趋化作用。此外,Duvelisib还可以抑制CXCL12诱导的T细胞迁移和巨噬细胞的M- CSF和IL-4驱动的M2极化[17]。
Copiktra®获批治疗CLL/SLL是基于一项随机、多中心、开放标签的临床三期试验(NCT02004522),比较Copiktra®与ofatumumab治疗复发或难治性CLL或SLL的患者。该试验纳入至少经过一次治疗的患有CLL(N = 312)或SLL(N = 7)的共计319名成人患者,该研究将患者按(1:1)随机分为每日两次口服25mg Copiktra®直至疾病好转或不可接受的毒性或者接受Ofatumumab静脉给药7个周期。而接受过至少2次治疗的196名患者,其中95名随机接受Copiktra®治疗,101名接受ofatumumab治疗,由独立评审委员会(IRC)评估的中位无进展生存期在Copiktra®组为16.4个月,ofatumumab组为9.1个月(风险比为0.40;标准误差为0.2)。几乎是ofatumumab的2倍,对于Copiktra®和ofatumumab组,每个IRC的总反应率(ORR)分别为78%和39%(差异为39%,标准误差为6.5%)。Copiktra®治疗组的主要和次要终点均得到显著改善。
Copiktra®获批治疗FL是基于一项单臂多中心试验(NCT02204982),该试验纳入了83例FL患者,这些患者使用利妥昔单抗难以治疗,无论是化疗还是放射免疫治疗。由IRC确定的ORR为42%(95%CI:31, 54),41%的患者经历部分反应,1名患者具有完全反应。在35名响应患者中,15名(43%)维持至少6个月的反应,6名(17%)维持至少12个月的反应。Copiktra®组相比利妥昔单抗组对FL患者的治疗得到了显著改善[18]。
Copiktra®是第一个被FDA批准的PI3Kδ和PI3Kγ的双重抑制剂,是CLL/SLL和FL患者不断发展的治疗范式的重要补充,Copiktra®是医生治疗设备的一个重要补充。此外,在美国和欧盟,duvelisib均被授予治疗CLL、SLL、FL的孤儿药地位。
5、Fremanezumab
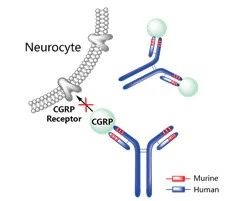
Fremanezumab于2018年9月14日获美国食品药品管理局(FDA)批准上市,最初由Rinat Neuroscience(2006年被辉瑞收购)开发,2013年Labrys Biologics(2014年被梯瓦收购)获得该药的全球研发权。商品名为Ajovy®,被批准用于治疗成人偏头痛[19]。
降钙素基因相关肽(CGRP)是一个含有37个氨基酸残基的酸性神经肽,是目前最为强大的内源性血管舒张物质。CGRP 具有两种主要亚型(α和β),它们有相似的结构和生物活性,且由单独的基因合成。CGRP 几乎存在于所有的感觉神经纤维内,且分布与血管紧密相连,α-CGRP主要存在于中枢和周围感觉神经系统中,其中三叉神经节和背根神经节是其合成及释放的主要场所。β-CGRP主要存在于肠道神经系统。CGRP结合于特异性的CGRP受体发挥生物学活性,其受体由7个跨膜蛋白复合体(降钙素受体样受体(calcitonin receptor-likereceptor,CLR),1个跨膜蛋白受体活性修饰蛋白(receptor activity modifying protein 1,RAMP-1)和1个胞内蛋白-受体合成蛋白(receptor component protein,RCP)组成。RAMP-1是一类小分子跨膜蛋白,以分子伴侣的形式介导CLR的膜转位。RCP是一类小分子多肽,介导CLR下游信号传导。CGRP与三叉神经血管系统的CGRP受体特异性结合,引起神经源性炎症、神经敏化和调节基因的表达,触发偏头痛的发作,且有相关作用机制的提出和实验的研究[20]。
Ajovy®是一种靶向于降钙素基因相关肽(CGRP)的全人源化IgG2Δa/kappa型单克隆抗体,Fremanezumab是通过重组DNA技术在中国仓鼠卵巢(CHO)细胞中产生的。抗体由1324氨基酸组成,其分子量约为148 kDa[21]。
Ajovy®的获批是基于临床三期开发项目HALO的数据。该项目包括两个关键性三期临床研究(HALO-EM,HALO-CM),入组超过2000例发作性偏头痛(EM)和慢性偏头痛(CM)患者,评估了每月一次和每季度一次皮下注射Ajovy®作为单药疗法以及与口服预防性药物联合用药的疗效和安全性。来自该项目的数据显示,治疗12周期间,与安慰剂组相比,Ajovy®治疗组患者在全部主要和次要终点以及在所有预先指定的分析中均实现了临床意义和统计学意义的显著改善,包括:每月偏头痛和头痛天数显著减少、急救用药和残疾显著减少、生活质量显著改善。安全性方面,最常见的不良事件为注射部位硬结、红斑和瘙痒,安慰剂组和Ajovy®治疗组发生率相似[22]。
Ajovy®是目前首个也是唯一一个可同时每季度一次和每月一次给药的抗CGRP偏头痛药物,是FDA批准用于成人偏头痛预防性治疗的第二种抗CGRP单克隆抗体。目前,在偏头痛治疗方面,预防性治疗方案很有限,Ajovy®将为医生和患者提供一种重要的治疗选择。
6、Moxetumomab pasudotox

Moxetumomabpasudotox由阿斯利康公司研发,于2018年9月13日获美国食品药品管理局(FDA)批准上市,商品名为Lumoxiti®,被批准用于治疗毛细胞白血病。该产品获FDA优先审评资格,2013年被欧洲EMA认证为治疗B淋巴细胞性白血病/淋巴瘤的孤儿药[23]。
毛细胞白血病(HCL)是一种罕见的,慢性的和生长缓慢的白血病,其中骨髓过量产生异常的B细胞淋巴细胞,是一种少见的B淋巴细胞肿瘤。常以全血细胞减少和脾脏肿大为特点,约占全部白血病的2%。HCL患者常伴有自身免疫性疾病的一些表现,如关节炎的症状、关节痛、皮肤红斑、皮肤损害、低热等,这些症状与肿瘤负荷无关,常为自限性的,皮质激素治疗有效。HCL的中位发病年龄为50岁,尚无儿童或青少年发病报道。约80%的患者为男性。就诊时约1/4的患者主诉为脾脏肿大所致的腹部胀满或不适;1/4的患者有疲乏无力、体重下降;1/4的患者有血小板减少引起的出血趋势或继发于粒细胞和单核细胞减少的易感染倾向;其他患者可能在查体时发现血细胞计数异常或脾脏肿大[24]。

Lumoxiti®的获批是基于一项单臂的开放性的临床三期试验,该试验对80名至少两次接受过HCL治疗的患者进行了全身治疗。试验的主要终点是持久的完全反应,试验中30%的患者达到持久CR,总体反应率(对治疗有部分或完全反应的患者数)为75%。血液学缓解率为80%[25]。
许多毛细胞白血病患者通过现有治疗可以获得缓解,但是30%至40%将在首次治疗后5至10年再次复发。随后的治疗,反应持续时间减少,毒性积累,很少有批准的治疗方案。Lumoxiti®作为一种重组的靶向于CD22的抗毒素,是美国针对复发或难治性毛细胞白血病(HCL)成年患者的一流治疗药物,是一种有前景的HCL非化疗药物,可解决医生及其患者未满足的医疗需求。
7、Gilteritinib fumarate
Gilteritinib fumarate由安斯泰来研发,于2018年9月21日获日本医药品医疗器械综合机构(PMDA)批准上市,商品名为Xospata®。它是一种FLT3/AXL抑制剂,被批准用于治疗FLT3突变阳性的复发或难治性急性髓细胞白血病[26]。
急性髓细胞性白血病(Acute myeloid leukemia,AML)是一组高度异质性的克隆性疾患,具有独特的细胞形态学、免疫表型、细胞遗传学及分子遗传学特征。一些重现性基因突变已被证实是AML诊断分型、危险分层及评估预后的重要因素,并且一些针对突变基因的特异性靶向药物也逐渐进入临床研究[27]。急性髓细胞白血病(AML)占急性白血病的50%以上,以40岁的成年人多见,发病率随年龄增长而上升。急性髓细胞白血病会导致患者出现贫血、出血、发热等临床症状,不仅不利于患者身体健康,而且还会对患者的生命安全构成威胁[28]。

Xospata®的获批是基于对在多国进行的临床三期试验(NCT02421939)研究的中期结果的CR/CRh2分析。ADIMRAL的目的是比较Xospata®与挽救性化疗在有FLT3突变并已复发的或难治性成人AML的一线治疗。患者按2:1的比例随机接受Xospata® (120mg)或挽救性化疗,Xospata®已经证明具有抑制FLT3内串联复制和FLT酪氨酸激酶结构域突变的活性。这两个突变存在于大约三分之一的AML患者中[29]。
相对于其他的癌症,急性骨髓性白血病还是比较罕见的疾病:中国发病率为1.62/10万,低于美国发病率4.36-6.13/10万和日本3.25-5.85/10万。虽然可以是原发性的,也可能是继发性的,因为放射线暴露、致癌化学药物暴露造成,或曾经有其他血液疾病,如骨髓化生不良症候群(myelodysplastic syndrome)、骨髓增生性疾病(myeloproliferative disorder)演变而成。患者人群中男性较女性略高。Xospata®的上市为治愈急性髓细胞白血病提供了新的选择方案[30]。
8、Anagliptin/ Metformin Hydrochloride

安奈格列汀/盐酸二甲双胍由Suzuken的子公司三和化学研究所研发,于2018年9月21日获日本医药品医疗器械综合机构(PMDA)批准上市,商品名为Metoana®,被批准用于治疗2型糖尿病[31]。
2型糖尿病原名叫成人发病型糖尿病,多在35~40岁之后发病,是一种慢性代谢疾病,占糖尿病患者90%以上。2型糖尿病患者体内产生胰岛素的能力并非完全丧失,有的患者体内胰岛素甚至产生过多,但胰岛素的作用效果较差,因此患者体内的胰岛素是一种相对缺乏,可以通过某些口服药物刺激体内胰岛素的分泌。但到后期仍有一些病人需要使用胰岛素治疗。2型糖尿病中一部分病人以胰岛素抵抗为主,病人多肥胖,因胰岛素抵抗,胰岛素敏感性下降,血中胰岛素增高以补偿其胰岛素抵抗,但相对病人的高血糖而言,胰岛素分泌仍相对不足。此类病人早期症状不明显,仅有轻度乏力、口渴,常在明确诊断之前就可发生大血管和微血管并发症。饮食治疗和口服降糖药多可有效。另一部分病人以胰岛素分泌缺陷为主,临床上需要补充外源性胰岛素[32]。
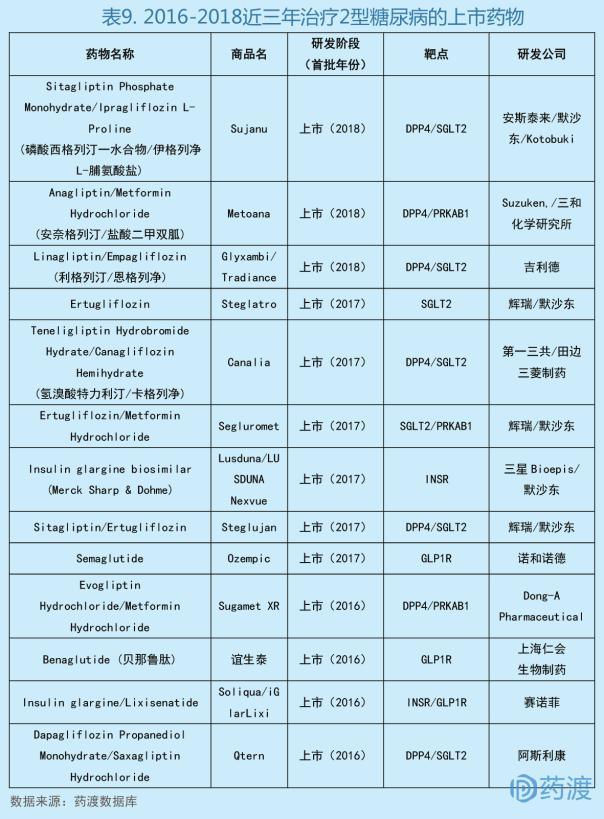
安奈格列汀是一种长效选择性二肽基肽酶-4 (DPP-4)抑制剂,能有效抑制DPP-4活性,使餐后分泌的胰高血糖素样肽-1 (GLP-1)和GIP不被DPP-4降解,延长GLP-1和GIP作用时间,促进胰岛素释放,降低餐后血糖。盐酸二甲双胍是一种双胍类抗糖尿病药,经口给药,用于2型糖尿病的治疗,并且是超重患者的首选药物。
联合用药的复方制剂是近两年上市的以及晚期的研发项目热点之一,并将成为未来糖尿病用药研究的大方向。目前临床晚期项目的主要方向是:SGLT-2抑制剂与二甲双胍的复方制剂,DPP-4与SGLT-2抑制剂的复方制剂,以及胰岛素与GLP-1激动剂的联合用药开发。复方制剂的好处是显而易见的:由于两种药物针对的发病机制不一样,联合协同可以针对2型糖尿病的不同发病机制和病理环节进行治疗;两种药物联合不增加糖尿病病人的体重,部分病人还可减轻体重;复方制剂减少病人服用药片数量,增加患者依从性[33]。Metoana®的上市为糖尿病患者提供了更多的选择。
9、Lorlatinib
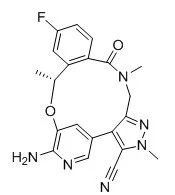
Lorlatinib是辉瑞研发的小分子抗癌药,于2018年9月21日获日本医药品医疗器械综合机构(PMDA)批准上市,商品名为Lorbrena®,获批用于治疗ALK融合基因阳性无法切除的复发性非小细胞肺癌[34]。
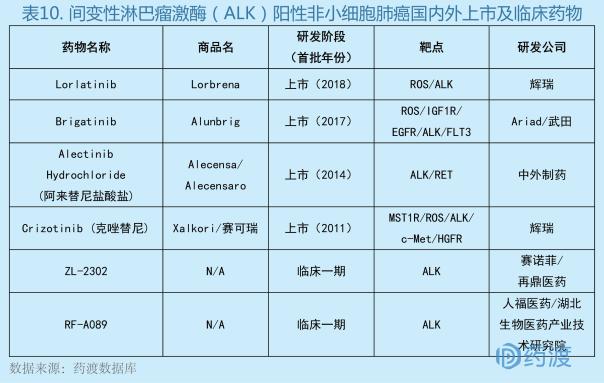
间变性淋巴瘤激酶(anaplasticlymphomakinase,ALK)阳性非小细胞肺癌(non-small celllung cancer,NSCLC)是肺癌的一个重要亚型,间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)基因重排是发生非小细胞肺癌(non-small cell lung cancer,NSCLC)的重要致癌驱动因素之一,ALK阳性的NSCLC患者易发生脑转移,而ALK靶向抑制剂相对于一线化疗对脑转移有更好的疗效。但经第一代ALK抑制剂治疗后患者易耐药,进而出现颅内进展, 第二代和第三代ALK抑制剂可增强其对中枢神经系统的渗透性、提高其到达靶点后的结合力,对脑转移癌有较好的治疗效果[35]。

Lorbrena®的批准是基于一项I/II期(NCT01970865)研究中的二期数据,该研究评估了lorlatinib对接受过不同ALK抑制剂患者的疗效和安全性,结果曾在WCLC2017大会上公布。结果显示,lorlatinib一线治疗30位初治ALK+NSCLC患者,ORR为90%,疾病控制率97%,只有一位患者无效;lorlatinib二线或三线治疗59位使用过克唑替尼或者克唑替尼+化疗的患者,ORR高达69%;对于使用过2-3种ALK抑制剂外加化疗的患者,lorlatinib作为三线甚至五线药物使用,ORR依然达到39%[36]。
转移性ALK突变阳性NSCLC患者面临的一大挑战是对初始治疗药物发生耐药,会导致疾病快速进展。Lorlatinib可以克服第一代和第二代ALK抑制剂耐药,在多项临床研究中获得了积极的结果,Lorbrena®的获批意味着患者的用药选择更加丰富。
10、Omidenepag isopropyl

Omidenepag isopropyl是由日本参天制药及宇部兴产株式会社合作开发,于2018年9月21日获PMDA批准上市,商品名为Eybelis®。Omidenepag isopropyl是一种前列腺素受体激动剂,通过放松睫状肌降低眼压,并通过葡萄膜巩膜途径增加房水外流,治疗青光眼和高眼压症[37]。
青光眼是一系列会导致视神经受损,进而造成视力丧失的眼疾,多数系眼内压力升高所致,有剧烈头痛、恶心、呕吐等症,由于眼内压力升高,使眼球发硬,而导致祝力骤然下降或失明[38]。青光眼是导致人类失明的三大致盲眼病之一,总人群发病率为1%,45岁以后为2%。临床上根据病因、房角、眼压描记等情况将青光眼分为原发性、继发性和先天性三大类。
高眼压症是眼压高于21 mmHg的统称,可见于各种原因如外伤性前房出血、眼眶水肿、术后粘弹剂残留、眼内炎、使用糖皮质激素、瞳孑L阻滞和特发性等。高眼压症本身不是一种疾病,它只是用来描述一类个体的术语,这些个体比一般人群更应受到密切观察以早期发现青光眼损害发生[39]。
Eybelis®的批准是基于两项随机的、多中心的、开放性标签的临床三期试(NCT02822742,NCT02981446)。第一个临床试验主要评估了对拉坦前列素滴眼液无应答者低应答的原发性开角型青光眼及眼压过高患者在使用Eybelis®后的安全性及有效性,该试验的首要治疗终点是对眼压的有效控制,在第二个临床试验中,主要对比了Eybelis®和拉坦前列素滴眼液在开角型青光眼及眼压过高患者中使用的安全性和有效性的评估。该试验的首要治疗终点是平均昼夜压。两项试验均得到了不劣于阳性对照组的疗效结果,实现了对眼压的有效控制。
眼压下降是目前治疗青光眼疾病最可靠的方法,经临床试验结果显示Eybelis®可以有效的控制眼压,Eybelis®的上市为治疗开角型青光眼及眼压过高提供了更多有效的选择。
11、Fruquintinib (呋喹替尼)

Fruquintinib(呋喹替尼)于2018年9月5日获NMPA(原CFDA)批准上市,商品名为爱优特®,用于治疗转移性结直肠癌。呋喹替尼是一种高选择性的血管内皮生长因子受体(VEGFR)口服抑制剂,有潜力成为全球同类最佳的能够治疗多种实体瘤的VEGFR抑制剂。高效、低毒、适合联合用药是呋喹替尼区别于其他已获批的小分子VEGFR抑制剂的优良特性[40]。
结肠直肠癌是最常见的恶性肿瘤之一,其发病率在全世界范围内居恶性肿瘤第3位,死亡率也居第3位。结肠直肠癌在我国的发病率呈上升趋势,目前约万分之二至三。其中上海地区已上升至第2位[41]。诊断时,50%~60%的肿瘤转移,预后较差。化疗被认为是结直肠癌的标准治疗,但化疗的局限性不容忽视,如选择性低、肿瘤组织浓度不足、全身毒性等[42]。
爱优特®单药适用于既往接受过氟尿嘧啶类、奥沙利铂和伊立替康为基础的化疗,以及既往接受过或不适合接受抗血管内皮生长因子(VEGF)治疗、抗表皮生长因子受体(EGFR)治疗(RAS野生型)的转移性结直肠癌患者。呋喹替尼是喹唑啉类小分子血管生成抑制剂,通过作用VEGFR激酶家族来抑制血管内皮细胞的增殖、迁移和管腔形成,从而抑制肿瘤新生血管形成及肿瘤生长,为转移性结直肠癌患者提供新的治疗途径[43]。
FRESCO研究是国内多中心、随机、双盲、安慰剂对照的呋喹替尼三期临床试验,纳入二线或以上标准化疗失败的转移性结直肠癌患者,以2:1随机入组,最终278例患者进入呋喹替尼联合最佳支持治疗组,138例患者进入安慰剂联合最佳支持治疗组。该研究达到主要终点和所有次要终点,呋喹替尼组患者数据均显著优于安慰剂组,差异均有统计学意义(主要终点中位总体生存时间9.30个月比6.57个月,P<0.001:次要终点无进展生存时间3.71个月比1.84个月,P<0.001;次要终点客观反应率4.7%比0,P=0.012;次要终点疾病控制率62.2%比12.3%,P<0.001),且前者死亡风险降低35%(风险比为0.65)。且呋喹替尼安全性良好,不良反应可控,未见严重非预期安全信号。因此,呋喹替尼或将成为晚期结直肠癌三线治疗标准用药之一[44]。
据呋喹替尼三期临床研究结果显示,该药可降低患者35%的死亡风险,并可降低患者74%的疾病进展风险[45]。爱优特®(呋喹替尼)为转移性结直肠癌患者提供了新的治疗途径。
参考文献
1.药渡数据:https://data.pharmacodia.com/web/basic/basic_detail_PB0450.html(accessed September 2018).
2.FDA官网:https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm622044.htm(accessed September 2018).
3.RegeneronPharmaceuticals官网:https://newsroom.regeneron.com/news-releases/news-release-details/fda-approves-libtayor-cemiplimab-rwlc-first-and-only-treatment(accessed September 2018).
4.药渡数据:https://data.pharmacodia.com/web/basic/basic_detail_PB0272.html(accessed September 2018).
5.新浪医药新闻:http://med.sina.com/article_detail_103_2_43730.html (accessed September2018).
6.Lilly 官网:https://investor.lilly.com/news-releases/news-release-details/lillys-emgalitytm-galcanezumab-gnlm-receives-us-fda-approval(accessed September 2018).
7.药渡数据:https://data.pharmacodia.com/web/basic/basic_detail_PN0726.html(accessed September 2018).
8.陈·杜克森索斯·泰斯勒马丁·格利夫. 治疗非小细胞肺癌的方法, CN103958681A.
9.中文版癌症综合信息库:http://pdq.cicams.ac.cn/PDQ/DATA/CDR62932_zh_page1.html.(accessed September 2018)
10.Lovly CM, Horn L. Molecular profiling of lungcancer. My Cancer Genome; 2016. Availableat:https://www.mycancergenome.org/content/disease/lung-cancer/. (accessedSeptember 2018)
11.Pao W, Miller VA. Epidermal growth factor receptormutations, small-molecule kinase inhibitors, and non-small-cell lung cancer:current knowledge and future directions. J Clin Onc. 2005; 23:2556-2568.
12.Pfizer官网:https://www.pfizer.com/news/press-release/press-release-detail/u_s_fda_approves_vizimpro_dacomitinib_for_the_first_line_treatment_of_patients_with_egfr_mutated_metastatic_non_small_cell_lung_cancer(accessed September 2018).
13.药渡数据:https://data.pharmacodia.com/web/basic/basic_detail_PN0858.html(accessed September 2018).
14.中华医学会血液学分会、中国抗癌协会血液肿瘤专业委员会,中国慢性淋巴细胞白血病/小淋巴细胞淋巴瘤的诊断与治疗指南(2015年版),中华血液学杂志2015年10月第36卷第10期,809-813.
15.NCCN guidelines for patients: chronic lymphocyticleukemia 2018.
16.刘树梅, 李莉娟, 张连生. 滤泡性淋巴瘤免疫治疗新进展[J]. 中国肿瘤生物治疗杂志, 2016, 23(4): 566-570.
17.FDADatabase.
https://www.accessdata.fda.gov/drugsatfda_docs/label/2018/211155s000lbl.pdf(accessed September 2018).
18.Drugbank https://www.drugbank.ca/drugs/DB11952 (accessed September 2018).
19.药渡数据:https://data.pharmacodia.com/web/basic/basic_detail_PB0583.html(accessed September 2018).
20.汪晶晶, 潘永惠. CGRP 与偏头痛伴发焦虑抑郁的关系.《脑与神经疾病杂志》, 2017年第4期252-256.
21.FDA Database. https://www.accessdata.fda.gov/drugsatfda_docs/label/2018/761089s000lbl.pdf(accessed September 2018).
22.新浪医药新闻:http://med.sina.com/article_detail_103_2_52798.html(accessed September 2018).
23.药渡数据:https://data.pharmacodia.com/web/basic/basic_detail_PB0217.html(accessed September 2018).
24.A+医学百科:http://www.a-hospital.com/w/%E6%AF%9B%E7%BB%86%E8%83%9E%E7%99%BD%E8%A1%80%E7%97%85.
25.AstraZeneca 官网:https://www.astrazeneca.com/media-centre/press-releases/2018/us-fda-approves-lumoxiti-moxetumomab-pasudotox-tdfk-for-certain-patients-with-relapsed-or-refractory-hairy-cell-leukaemia.html(accessed September 2018).
26.药渡数据:https://data.pharmacodia.com/web/basic/basic_detail_PN1278.html(accessed September 2018).
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












学习了,谢谢作者分享!
95