BLOOD:ETP表型和T-ALL微小残留病的预后意义:一项儿童肿瘤学小组研究
2023-10-10 将军的九分裤 MedSci原创 发表于上海
该研究是一项针对新诊断的T-ALL患者的大型、多中心随机III期试验,在这项试验中,MRD状态而不是ETP状态被用于风险分层。
早期胸腺前体(ETP)免疫表型在t细胞急性淋巴细胞白血病(T-ALL)中预后较差,需要使用当代风险调整疗法进行前瞻性确认。在2009年-2014年期间,1256名新诊断的儿童和青年成人在COGAALL0434登记,在中央参考实验室使用流式细胞仪评估ETP状态和微小残留疾病(MRD)。

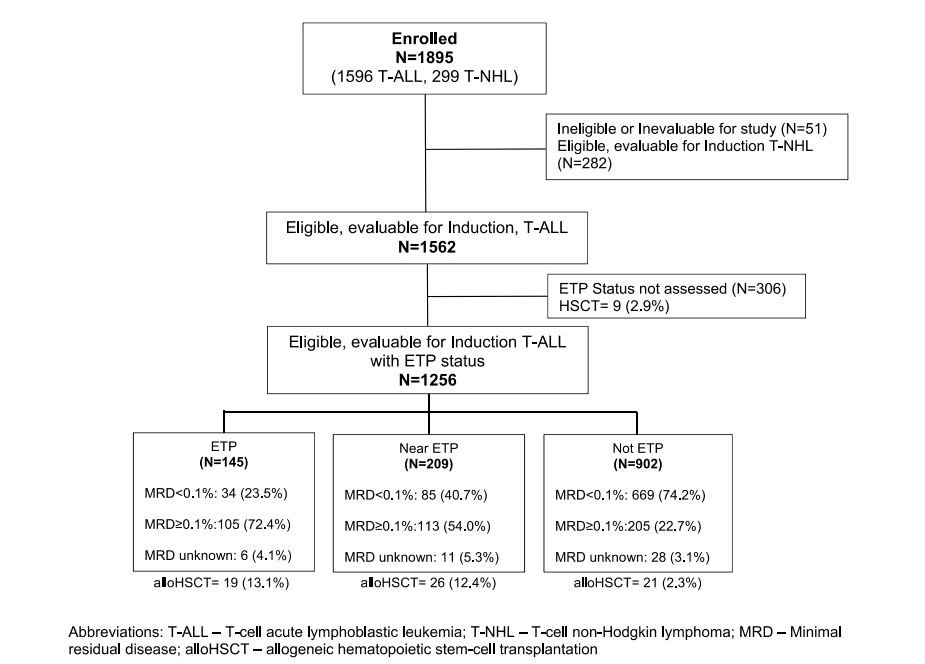
图1 研究流程图

图2 ETP状态的无事件生存期(EFS)、总生存期(OS)和累积复发率(CIR)
(A) ETP的5年EFS发生率为80.4±3.9%,近ETP为81.1±3.3%,非ETP为85.3±1.4% (P=0.1679)。(B) ETP的5年OS率为86.8±3.4%,近ETP为89.6±2.6%,非ETP为90.0±1.2% (P=0.3297)。(C) ETP的5年CIR为6.7±2.2%,近ETP为10.1±2.1%,非ETP为8.8±1.0% (P=0.5411)。(D) 5年累积缓解死亡率:ETP组为5.3±2.0%,近ETP组为1.0±0.7%,非ETP组为3.2±0.6% (P=0.0959)
研究对象被归类为ETP(n=145;11.5%),近ETP(n=209;16.7%)和非ETP(n=902,71.8%)。尽管ETP(6.2%)和近ETP(6.2%)诱导失败率高于非ETP(1.2%),但3组均表现出良好的5年无事件生存期(EFS)和总生存期(OS):ETP(80.4±3.9%;86.8±3.4%)、近ETP(81.1±3.3%;89.6±2.6%)和非ETP(85.3±1.4%;90.0±1.2%)。
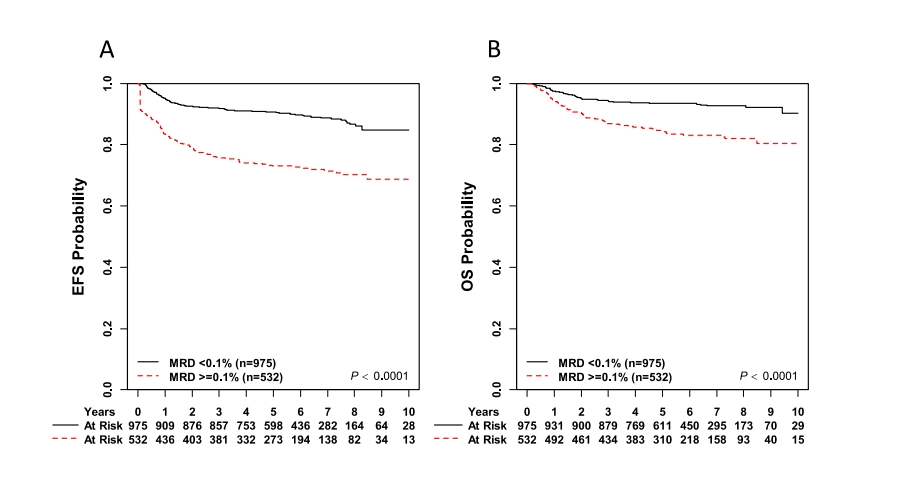
图3 诱导结束时最小残留疾病(MRD)的无事件生存期(EFS)和总生存期(OS)。
(A) EOI MRD≥0.1%患者的五年EFS为73.1±2.3%,EOI MRD≤0.1%患者的五年EFS为90.6±1.1%
(B) EOI MRD≥0.1%患者的5年OS为84.3±1.9%,EOI MRD≤0.1%患者的5年OS为93.4±1.0%
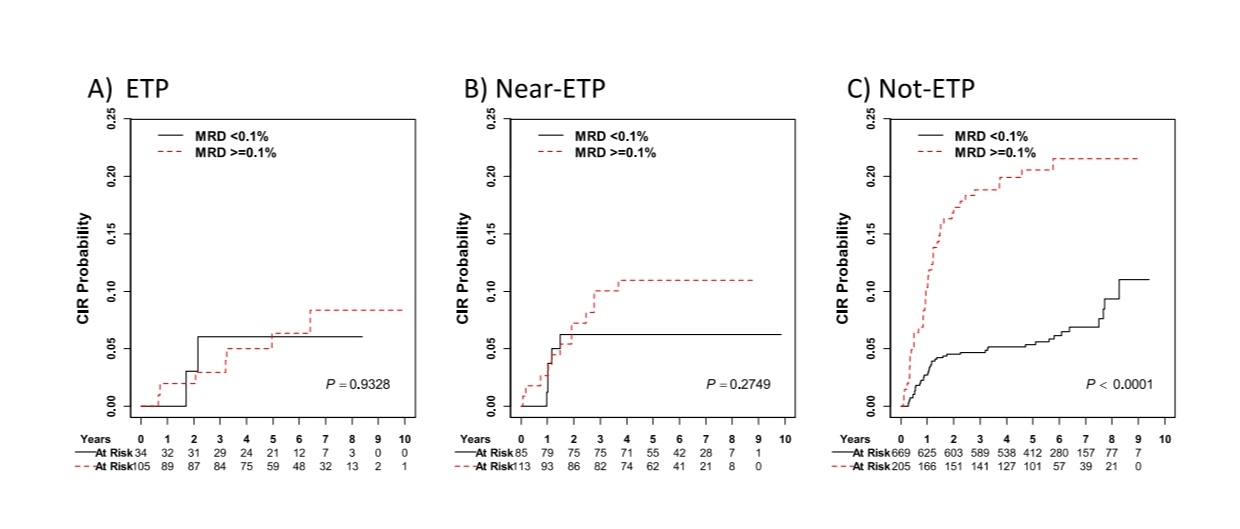
图4 ETP、近ETP和非ETP患者诱导结束时最小残留病(MRD)的累积复发率(CIR)
(A) MRD≥0.1%的ETP患者5年CIR为6.3±2.7%,MRD≥0.1%的患者为11.0±3.0%。(P = 0.9328)
(B) MRD≥0.1%的近ETP患者5年CIR为6.3±2.7%,MRD≥0.1%的近ETP患者为11.0±3.0%。(P = 0.2749)
(C) MRD<0.1%的非ETP患者的5年CIR为5.4±0.9%,MRD≥0.1%的为20.5±2.9%。(P < 0.0001)
对于第29天MRD<0.01%和以及MRD在0.01%-0.1%之间的受试者,EFS或OS没有差异。然而,对于近ETP和非ETP患者,第29天MRD≥0.1%与较差的EFS和OS相关,而对于ETP患者则不相关。近ETP和非ETP的患者中白细胞计数≥20万/微升的EFS和OS较差,而ETP患者则没有这种情况。对于第 29 天 MRD ≥1% 的受试者,终末巩固 MRD ≥0.01% 是较差 EFS 的显著预测指标。
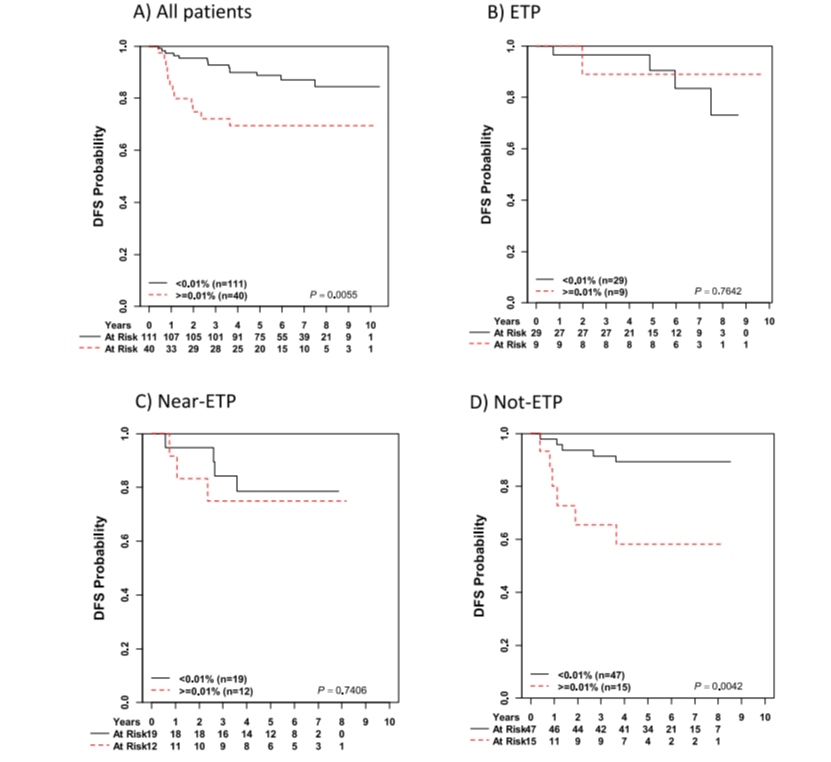
图5 在第29天MRD≥1%的ETP、近ETP和非ETP患者中,以巩固结束(EOC)最小残留病(MRD)衡量的无病生存(DFS)
总的来说,当被视为单个变量时,具有所有三种T-ALL表型的受试者具有相似的结果,并且患有持续性诱导后疾病的受试者无论其ETP表型如何,其结果都较差。虽然ETP状态本身不能作为患者临床结局的独立预测指标,但未来的研究可能会为干细胞样T-ALL耐药性疾病的机制基础提供更多见解。
原始出处:
Wood B, Devidas M, Summers RJ, et al. Prognostic Significance of ETP Phenotype and Minimal Residual Disease in T-ALL: A Children's Oncology Group Study [published online ahead of print, 2023 Aug 9]. Blood. 2023;blood.2023020678. doi:10.1182/blood.2023020678
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言