化学药品及生物制品说明书通用格式和撰写指南
根据《药品注册管理办法》(国家市场监督管理总局令第27号),为规范申报资料的提交,在国家药监局的部署下,药审中心组织制定了《化学药品及生物制品说明书通用格式和撰写指南》。
国家药品监督管理局药品审评中心 - 化学药品 - 2023-07-20
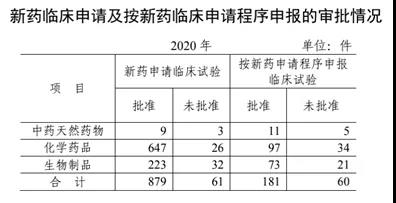
NMPA统计年报:7690家药企,创新药临床品种1096 个,生物制品 73 件,128件进口药获批上市!
今日NMPA发布2020年药品监督管理统计年度报告,以下为该报告的主要数据:
E药经理人 - 药企,NMPA - 2021-04-21
《化学药品和治疗用生物制品说明书中儿童用药相关信息撰写的技术指导原则(试行)》起草背景及要点内容
本文介绍了我国目前存在的药品说明书中儿童用药信息缺失或不完善问题,梳理了美国、欧洲和我国的法规制定历程,介绍了《化学药品和治疗用生物制品说明书中儿童用药相关信息撰写的技术指导原则(试行)》的起草背景。
中国新药杂志 - 化学药品 - 2023-05-31
新版《药典临床用药须知》面世
近日,《中华人民共和国药典临床用药须知》2015年版正式出版,《临床用药须知》覆盖了《国家基本药物目录》《国家基本医疗保险和工伤保险药品目录》及临床常用药品,药品信息量大,反映了药物最新研究进展,内容权威,将为指导药品使用环节的药品监管起到重要作用,也为建立上市药品目录集即“药品橙皮书”提供了严谨的标准素材。
健康报 - 新版,药典,须知 - 2017-10-23
2015版中国药典发布,附7大变化清单
6月10日,国家药典委员会发布公告,称根据《中华人民共和国药品管理法》,《中华人民共和国药典》(2015年版,以下简称药典)经第十届药典委员会执委会全体会议审议通过,予以发布,自2015年12月1日起实施。药典是药品行业的最重要的文件之一,其修改一直备受瞩目。2015年版是继我国1953年第一版药典以来的第十版药典。公开资料显示,2015年2月4日,第十届药典委员会执行委员会全体会议审议并通过了《
赛柏蓝 - 药典 - 2015-06-11
2012 国家基本药物临床应用指南(化学与生物制品)
人民卫生出版社 - 2013-08-01
FDA指导原则:新药和生物制品的获益与风险评估(草案)
本指南的目的是向药物赞助商和其他利益相关者阐明关于药物的益处、风险和风险管理选项的考虑如何影响食品和药物管理局(FDA 或机构)对新药做出的某些上市前和上市后监管决策 根据《联邦食品、药品和化妆品法案
FDA - 获益 - 2021-10-22
化学药品和治疗用生物制品上市后研究报告格式(征求意见稿)
化学药品和治疗用生物制品上市后研究报告格式(草案)1. 标题:包括说明研究设计的常用术语;带有最终报告日期和主要作者姓名和所属机构的子标题。
MedSci原创 - 临床试验,上市后研究 - 2014-03-03
化学药品和治疗用生物制品说明书中儿童用药相关信息撰写的技术指导原则(试行)
药品说明书中儿童用药信息缺失或表意不明确是导致儿科不规范处方行为和不合理用药引发儿童用药安全有效性问题的重要原因之一,为促进企业有序开展起草和完善药品说明书中儿童用药信息的相关工作,更好的指导临床合理
CDE - 儿童用药 - 2021-10-15
FDA指导原则:与 FDA 就药物和生物制品的复杂创新试验设计进行互动
本文件为申办者和申请人与 FDA 就药物或生物制品的复杂创新试验设计 (CID) 提案进行互动提供指导。 FDA 发布本指南是为了部分满足《21 世纪治愈法案》(《治愈法案》)第 3021 条的规定。
FDA - 临床研究设计 - 2021-10-22
化学药品和治疗用生物制品说明书中儿童用药相关信息撰写的技术指导原则(征求意见稿)
为促进企业有序开展起草和完善药品说明书中儿童用药信息的相关工作,药审中心起草了《化
CDE - 药品说明书,说明书 - 2021-05-16
FDA工业指南:人用药物和生物制品的可比性方案:工业化学、制造和控制信息(草案)
本指南为人用药物和生物制剂申请的持有人提供了通过使用可比性协议 (CP) 实施化学、制造和控制 (CMC) 批准后变更的建议。 它取代了 2003 年 2 月发布的指南草案,标题为“可比性
FDA - 生物制造,制造 - 2021-10-24
解读:2015版药典主要的七个方面变化
从总体情况看,2015版药典收载品种的安全性、有效性以及质量控制水平又有了新的提高,基本实现了“化学药、生物药达到或接近国际标准,中药主导国际标准”的总目标。 七大变化提升总
生物谷 - 药典 - 2014-10-11
为您找到相关结果约500个