Arimoclomol治疗丙型尼曼-皮克病:已完成新药申请
生物制药公司Orphazyme致力于开发热休克蛋白应答技术,Orphazyme近日宣布已向美国FDA提交了Arimoclomol的新药申请(NDA),用于治疗丙型尼曼-皮克病(NPC)。
MedSci原创 - Arimoclomol,丙型尼曼-皮克病 - 2020-07-22
Aurinia已完成Voclosporin的FDA新药申请,用于治疗狼疮性肾炎
Voclosporin可能成为FDA批准的首个治疗狼疮性肾炎的药物。
MedSci原创 - 狼疮性肾炎,钙调神经磷酸酶抑制剂,Voclosporin - 2020-05-27
FibroGen向美国FDA提交Roxadustat治疗慢性肾病贫血患者的新药申请
FibroGen近日宣布向美国FDA提交了Roxadustat治疗慢性肾脏病(CKD)贫血的新药申请(NDA),包括非透析依赖(NDD)和透析依赖(DD)的CKD患者。
MedSci原创 - roxadustat,FDA,FibroGen - 2019-12-24
Forest向FDA提交美金刚ER/多奈哌齐FDC 新药申请
森林实验室(Forest Lab)和合作伙伴Adamas制药公司3月4日宣布,已向FDA提交了缓释美金刚(memantine ER)+多奈哌齐(donepezil)固定剂量组合产品(FDC)的新药申请(
生物谷 - 新药,FDA - 2014-03-06
拜耳向EMA及FDA提交抗癌新药regorafenib上市许可申请
旗下拜耳医药保健公司(Bayer HealthCare)宣布,已向欧洲药品管理局(EMA)提交了口服多激酶抑制剂(oral multi-kinase inhibitor)regorafenib的上市许可申请(Marketing Authorization Application),同时已向FDA提交了该药的新药申请(New Drug Application,
生物谷 - 新药,FDA - 2012-05-24
ViiV Healthcare在美国提交了艾滋病毒新药fostemsavir的申请
葛兰素史克(GSK)控股的HIV公司ViiV Healthcare已在美国递交了fostemsavir的新药申请,该药物是一种用于治疗HIV-1感染的一线抑制剂。
MedSci原创 - ViiV,Healthcare,美国,艾滋病毒,fostemsavir,申请 - 2019-12-07
武田制药宣布FDA接受其补充新药申请并给予优先审查,将酪氨酸激酶抑制剂ALUNBRIG用作ALK +转移性非小细胞肺癌的一线治疗
武田制药有限公司宣布,美国食品药品监督管理局(FDA)已对该公司的补充新药申请(sNDA)给予优先审查,以扩大其ALUNBRIG(brigatinib)的适应症,用作经FDA批准的检测方法检测的间变性淋巴瘤激酶阳性
MedSci原创 - 武田制药,补充新药申请,优先审查,酪氨酸激酶抑制剂,Alunbrig,ALK,转移性非小细胞肺癌 - 2020-02-25
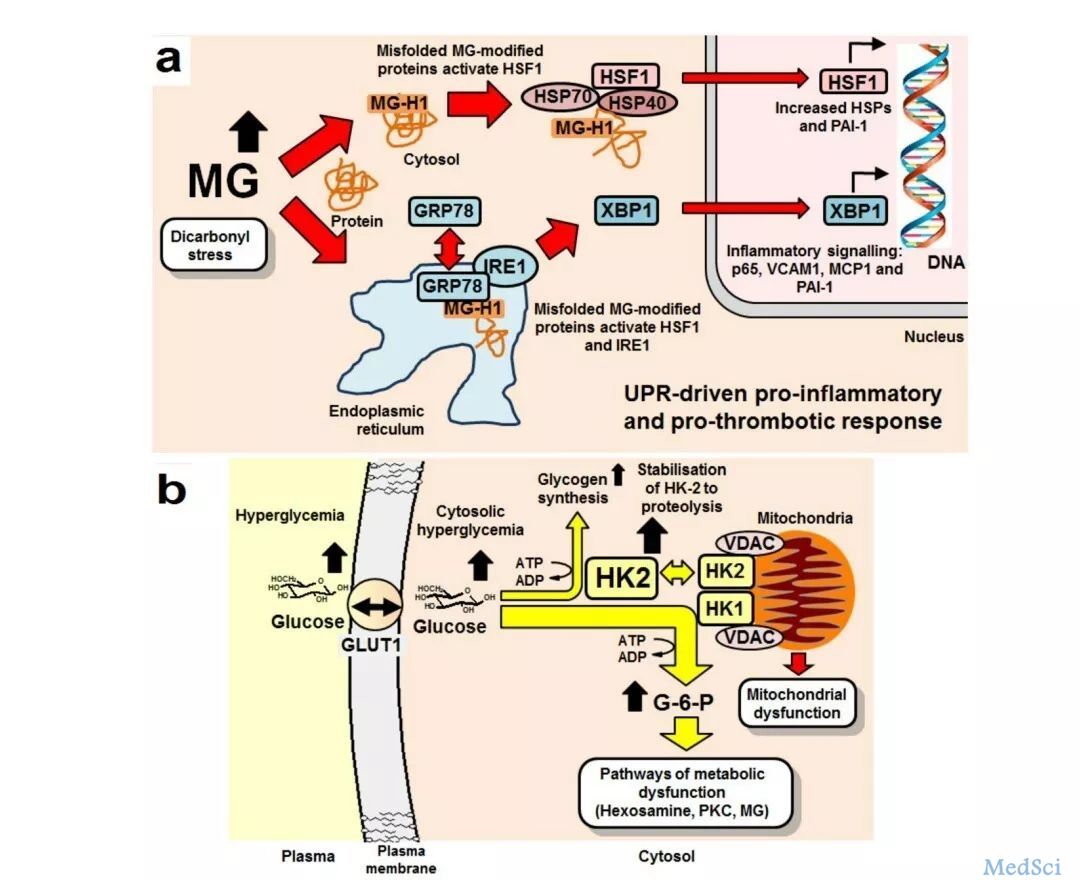
逆转糖尿病并发症有望 新型膳食补充剂助力新药开发!
糖尿病死亡者有一半以上是心脑血管所致,10%是肾病变所致,而因糖尿病截肢的患者是非糖尿病的10~20倍。临床数据显示,3年以上的糖尿病患者,出现并发症的几率在46%以上,5年以上的糖尿病患者几率在61%以上,10年以上的糖尿病患者甚至高达98%,且并发症一旦产生,药物治疗很难逆转。近日,来自沃里克医学院的Naila Rabbani博士领导的研究团队在一项新的研究报告中发现了可以预防糖尿病并发症引起
转化医学网 - 糖尿病并发症 - 2019-06-10
FDA接受审查阿斯利康肿瘤学药物易瑞沙(Iressa)新药申请
阿斯利康(AstraZeneca)近日宣布,FDA已接受审查肿瘤学药物易瑞沙(Iressa,通用名:gefitinib,吉非替尼)新药申请(NDA),作为一种靶向性单药疗法,用于经一款伴随诊断试剂盒证实为晚期或转移性表皮生长因子受体突变阳性
生物谷 - 阿斯利康,肿瘤学,药物 - 2014-12-04
药品评审中心(CDE)已受理Pamiparib治疗卵巢癌的新药申请
生物技术公司百济神州今日宣布,中国药品监督管理局(NMPA)的药品评审中心(CDE)已接受百济神州PARP1和PARP2研究性抑制剂Pamiparib的新药申请(NDA)。
MedSci原创 - 卵巢癌,PARP1,Pamiparib - 2020-07-18
帕金森病的新型辅助治疗:FDA接受了Opicapone的新药申请(NDA)
Neurocrine制药公司近日宣布,美国FDA已接受其新型选择性儿茶酚-O-甲基转移酶(COMT)抑制剂Opicapone作为帕金森病患者发生OFF事件时左旋多巴/卡比多巴的辅助治疗申请。
MedSci原创 - Opicapone,帕金森病,新型辅助治疗 - 2019-07-11
2005-2015年FDA抗肿瘤新药上市申请失败原因大盘点
为了掌握美国FDA否决抗肿瘤新分子实体药物新药上市申请的原因,美国FDA药品评审中心的管理人员系统调查了2005年3月17日到2015年3月17日这十年间,向美国FDA提交的抗肿瘤新分子实体药物新药上市申请的审批情况对美国FDA否决的抗肿瘤新分子实体药物,详细研究了新药上市申请被拒绝的深层原因,以期对从事抗肿瘤新分子实体药物研发的企业提供参考。 一、2005-2015年抗肿瘤新分子实体药物新药
新康界 - 抗肿瘤新药 - 2015-07-29
抗肿瘤新药首次人体临床试验申请临床相关资料准备建议
抗肿瘤新药是全球创新药研发热点,在当前创新药临床试验申请中大约占40%。然而,现阶段抗肿瘤药物首次
NMPA - 抗肿瘤,新药 - 2018-12-12
FDA接受葛兰素史克的补充新药申请,将其PARP抑制剂Zejula用作对铂类化疗敏感、晚期卵巢癌患者的一线维持治疗
葛兰素史克(GlaxoSmithKline)宣布,美国食品药品监督管理局(FDA)接受了该公司提交的补充新药申请(sNDA),以寻求批准其PARP抑制剂Zejula(niraparib)用作晚期卵巢癌女性患者一线治疗的维持治疗药物
MedSci原创 - FDA,葛兰素史克,补充新药申请,PARP抑制剂,Zejula,晚期卵巢癌,一线维持治疗 - 2020-02-25
CFDA拟推60天快速审批抗肿瘤创新药物临床研究申请
最近,有消息人士透露中国CFDA正考虑以抗肿瘤药物为试点,推行临床试验新药(IND)60天内快速审批的政策。如果属实,中国将成为继新加坡、韩国之后第三个对临床早期研究进行快速审批的亚洲国家。
生物谷 - CFDA,审批 - 2015-09-01
为您找到相关结果约500个