百时美在日本提交HCV全口服方案新药申请
Pharmaceuticals and Medical Devices Agency,PMDA)提交了其丙型肝炎(hepatitis C)实验性全口服方案(daclatasvir+asunaprevir,即DCV+ASV)的新药申请
生物谷 - 新药,FDA - 2013-11-05
Medivation与Astellas提交前列腺癌药物enzalutamide新药申请
2012年5月23日,Medivation公司及合作伙伴安思泰来(Astellas)公司向FDA提交了实验性前列腺癌药物enzalutamide(又名MDV-3100)的新药申请,并有望在6个月内获得审批此次申请并不出人意料,但对于总部位于旧金山的Medivation公司来说,是重要的一步。2年前,该公司实验性阿尔茨海默氏症药物Dimebon在III期试验中惨遭失败。不过,其前列腺癌药物en
生物谷 - 新药,FDA - 2012-05-24
透皮避孕贴片Twirla:已向FDA提交新药申请(NDA)
Agile是一家女性医疗保健公司,近日宣布已向美国食品和药品监督管理局(FDA)重新提交了其主要产品候选药物Twirla®的NDA。Twirla是一种研究性联合低剂量激素的避孕贴片(AG200-15)。
网络 - Twirla,避孕贴片,FDA - 2019-05-18
EMA接受辉瑞新药BZA/CE上市许可申请的审查
nbsp;欧洲药品管理局(EMA)表示,已接受对辉瑞(Pfizer)药物BZA/CE(bazedoxifene/conjugated estrogens,bazedoxifene/共轭雌激素)上市许可申请的审查BZA/CE是一种潜在的新药物,用于绝经后女性雌激素缺乏症及具骨折风险的女性骨质疏松症的治疗。辉瑞预计在2013年得到EMA的
生物谷 - 新药,FDA - 2012-07-24
健赞及Isis公司宣布提交HoFH药物KYNAMRO新药申请
2012年3月30日,健赞(Genzyme),赛诺菲(Sanofi)旗下公司,与Isis制药公司今天宣布称,健赞公司已向FDA提交新药申请(New Drug Application,NDA),寻求批准KYNAMRO
生物谷 - 新药,FDA - 2012-04-16
EMA接受审查阿斯利康新药naloxegol上市许可申请
阿斯利康(AstraZeneca)9月27日宣布,欧洲药品管理局(EMA)已接受审查实验性药物naloxegol上市许可申请(MAA)。
生物谷 - 新药,FDA - 2013-09-30
XenoPort向FDA提交XP23829研究性新药申请
2012年5月24日,XenoPort生物制药公司宣布,已向FDA提交XP23829的研究性新药申请(INDA),用于复发-缓解型多发性硬化症(RRMS)的治疗。
生物谷 - 新药,FDA - 2012-05-28
FDA批准Heron的补充新药申请以扩大CINVANTI的标签
致力于通过开发一流的治疗方法来改善患者的生活,以解决一些最重要的未满足的患者需求,Heron今天宣布美国食品和药品监督管理局(FDA)批准了Heron对CINVANTI(Aprepitant)可注射乳剂的补充新药申请
网络 - Heron,化疗,恶性,呕吐 - 2019-02-27
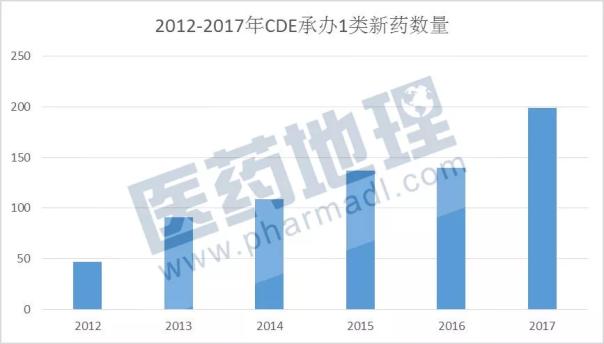
一大波重磅新药申请临床获CDE受理
solanezumab注射液 solanezumab一种抗被淀粉样蛋白单抗,也是礼来现有管线药物中最有“钱景”的一个,若能成功上市,预计2020年将给礼来带来近14亿美元的销售收入。 尽管solanezumab之前的两项 III 期临床研究EXPEDITION1(n=1012)和 EXPEDITION 2(n=1040 )均告失败,均未能改善AD患者的认知和生活自理能力,礼来最终还是决定再
医药魔方数据 - 新药,临床申请 - 2016-06-16
杜氏肌营养不良新药Viltolarsen下月申请,有望获批
由日本新药(Nippon Shinyaku)开发的Viltolarsen,又称NS-065,NCNP-01,是一个口服治疗杜肌氏营养不良的新药,由药企和科研机构,国际神经医学研究协作机构一起研制。Viltolarsen是由总部位于京都的日本新药研发,作用原理是反义核寡苷酸(Antisense oligon
健点子ihealth - 杜氏肌营养不良,Viltolarsen - 2019-08-06
Arimoclomol治疗丙型尼曼-皮克病:已完成新药申请
生物制药公司Orphazyme致力于开发热休克蛋白应答技术,Orphazyme近日宣布已向美国FDA提交了Arimoclomol的新药申请(NDA),用于治疗丙型尼曼-皮克病(NPC)。
MedSci原创 - Arimoclomol,丙型尼曼-皮克病 - 2020-07-22
大冢及Lundbeck长效版Abilify新药申请审批遭FDA推迟
FDA已推迟了长效版(每月一次)重磅抗精神病药物Abilify的新药审批申请。
生物谷 - 大冢,Lundbeck,Abilify,FDA - 2012-08-01
Intercept向美国FDA提交奥贝胆酸治疗NASH的新药申请
Intercept Pharmaceuticals是一家专注于治疗进行性非病毒性肝病的生物制药公司,近日宣布,已向美国FDA提交了奥贝胆酸(OCA)治疗非酒精性脂肪性肝炎(NASH)所致的纤维化的新药申请
MedSci原创 - FDA,Intercept,奥贝胆酸,NASH - 2019-09-29
Gabapentin口服液仿制药新药申请获得美FDA批准
Acella医药公司Gabapentin口服液仿制药申请(ANDA)获得美国食品药监局(FDA)批准。 FDA发现Acella仿制药申请的生物等效性上和治疗效果,和推荐药的是一样的。
中国医药123网 - 新药,FDA,Gabapentin - 2012-05-06
为您找到相关结果约500个