FDA批准四价脑膜炎球菌疫苗MenQuadfi的生物制剂许可
近日,美国食品药品监督管理局(FDA)已批准四价脑膜炎球菌疫苗MenQuadfi的生物制剂许可,用于预防2岁及以上人群的侵袭性脑膜炎。
MedSci原创 - 脑膜炎球菌疫苗,MenQuadfi - 2020-04-26
Evinacumab治疗纯合型家族性高胆固醇血症(HoFH):美国FDA已接受生物许可申请(BLA)
Evinacumab是一种研究性的全人源单克隆抗体,可结合并阻断血管生成素样3(ANGPTL3)。
MedSci原创 - 高胆固醇血症,家族性高胆固醇血症,Evinacumab - 2020-08-13
武田候选登革热疫苗(TAK-003)生物制品许可申请(BLA)获得美国食品药品管理局优先审查
武田正在4岁至60岁人群中评估TAK-003对任一登革热病毒血清型引起的登革热病的预防效果
网络 - 武田,登革热疫苗, 美国食品药品管理局 - 2022-11-24
通用型皮肤组织StrataGraft:BLA申请已经成功递交给FDA
StrataGraft是一种再生性皮肤组织,正在开发用于减少严重热灼伤患者的自体移植。
MedSci原创 - 通用型皮肤组织StrataGraft,生物制剂许可证申请(BLA) - 2020-06-10
强生向FDA提交申请寻求批准其抗CD38单抗DARZALEX皮下制剂治疗多发性骨髓瘤
强生制药公司今天宣布向美国食品和药物管理局(FDA)提交生物制剂许可证申请(BLA),寻求批准其DARZALEX(daratumumab)皮下制剂,用于治疗多发性骨髓瘤患者。
MedSci原创 - CD38单抗,Darzalex,皮下制剂,多发性骨髓瘤 - 2019-07-14
美国FDA批准辉瑞/BioNTech新冠疫苗用于12-15岁青少年
当地时间5月10日,美国FDA扩大了辉瑞新冠疫苗的紧急使用授权范围,将包括12至15岁的青少年人群。
MedSci原创 - 辉瑞/BioNTech - 2021-05-11
FDA接受Sacituzumab Govitecan治疗转移性三阴性乳腺癌的BLA
抗体药物偶联物领域领先的生物制药公司Immunomedics近日宣布,美国FDA已接受其Sacituzumab Govitecan治疗转移性三阴性乳腺癌(mTNBC)的生物制剂许可证申请(BLA)。
MedSci原创 - FDA,Sacituzumab,Govitecan,转移性三阴性乳腺癌 - 2019-12-27
科济生物CAR-T细胞疗法治疗复发或难治性多发性骨髓瘤,被FDA授予再生医学先进疗法称号
美国食品和药物管理局(FDA)已为科济生物医药CARsgen公司的CT053 CAR-T细胞疗法授予再生医学先进疗法(RMAT)称号。
MedSci原创 - 科济生物,Car-T细胞疗法,复发或难治性多发性骨髓瘤,FDA,再生医学先进疗法 - 2019-11-03
Bio-Thera向欧洲药品管理局提交了Avastin生物仿制药BAT1706的营销授权申请(MAA)。
中国生物制药公司Bio-Thera Solutions(百奥泰)近日宣布,已向EMA提交了BAT1706的MAA,BAT1706是Avastin®(贝伐单抗)的生物仿制药。
MedSci原创 - 贝伐单抗,Bio-Thera,BAT1706,Avastin生物仿制药,百奥泰 - 2020-11-29
全球首次批准 韩国上市世界首个膝骨关节炎基因疗法
7月12日,位于美国马里兰州的再生医学公司TissueGene表示,公司亚洲地区(包含韩国)独占性许可商Kolon Life Science收到了韩国食品药品安全部(MFDS)针对世界首个退行性关节炎治疗的细胞及基因疗法
新浪医药新闻 - 基因疗法,膝骨关节炎 - 2017-07-14
CTX001获得FDA快速通道资格用于治疗镰状细胞病
CRISPR治疗公司和Vertex制药公司近日宣布,美国食品和药品管理局(FDA)已授予CTX001快速通道资格用于治疗镰状细胞病(SCD)。CTX001是针对患有严重血红蛋白病患者的研究性、自体性、CRISPR基因编辑的造血干细胞疗法。
MedSci原创 - CTX001,镰状细胞病,地中海贫血,CRISPR - 2019-01-10
Keytruda第二个“不限癌种”上市申请获FDA优先审评
4月8日,默沙东(MSD)宣布,FDA已经接受并优先审评抗PD-1治疗药物Keytruda单药治疗肿瘤突变负荷高(TMB-H)且既往治疗后疾病进展的患者的补充生物制剂许可证申请(sBLA)。
生物探索 - FDA,默沙东 - 2020-04-09
FDA受理默沙东Remicade(类克)生物仿制药上市申请
美国制药巨头默沙东(Merck & Co)近日宣布,FDA已受理合作伙伴三星Bioepis(Samsung Bioepis)提交的生物仿制药SB2(infliximab,英夫利昔单抗)的生物制品许可申请(BLA)。该药是强生(JNJ)重磅品牌药Remicade(类克,通用名:infliximab,英夫利昔单抗)的生物仿制药。Remicade是全球最畅销的抗炎药,2014年全球销售额高达
生物谷 - 生物仿制药 - 2016-05-25
强生向FDA提交申请,将其抗CD38单抗Darzalex与Kyprolis和地塞米松联合治疗多发性骨髓瘤
强生制药宣布,已为其抗CD38抗体Darzalex(daratumumab)向美国食品和药物管理局(FDA)提交了新的申请,将Darzalex与Kyprolis(carfilzomab)和地塞米松(Dkd
MedSci原创 - 强生,FDA提交申请,抗CD38单抗,Darzalex,Kyprolis,地塞米松,联合治疗,多发性骨髓瘤 - 2020-02-14
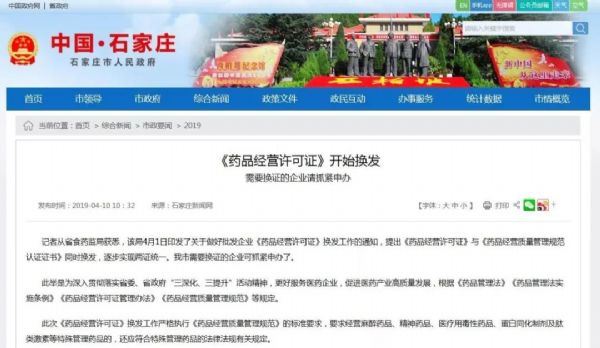
两证合一后,这些情况不再进行GSP认证!
日前,河北省药监局印发了关于做好批发企业《药品经营许可证》换发工作的通知,提出《药品经营许可证》与《药品经营质量管理规范认证证书》同时换发,逐步实现两证统一。
21世纪药店 - 两证合一,GSP认证 - 2019-04-16
为您找到相关结果约500个