好文推荐 | 肥胖引起血脑屏障功能障碍的表型和机制研究进展
2024-02-29 中风与神经疾病杂志 中风与神经疾病杂志 发表于上海
本文旨在探讨肥胖状态下BBB功能障碍的表型和潜在机制研究进展,着重阐述了BBB功能障碍在肥胖中的重要性及其对神经健康的影响,以指导未来的研究和临床实践。
摘要
肥胖是多种神经系统疾病的风险因素,全面了解肥胖对中枢神经系统的有害影响对预防和治疗肥胖相关的神经系统疾病有重要意义。血脑屏障是存在于血液和脑组织之间的调节界面,可防止有害物质进入大脑并清除脑组织产生的代谢废物,对脑微环境稳态平衡和神经生理功能具有重要作用。然而,大量研究表明肥胖可引起血脑屏障功能障碍,直接或间接促进了多种神经系统疾病的发生发展。本文系统总结了肥胖状态下血脑屏障功能障碍的表型和机制的最新研究进展,从血脑屏障通透性改变、转运功能障碍和神经炎症3个方面,分析了肥胖引起血脑屏障功能障碍的具体表型和调控机制,阐述了肥胖对血脑屏障功能的有害影响,以期为相关领域的基础研究和临床实践提供理论指导。
随着经济社会发展和生活水平提高,肥胖的流行率在全球范围内迅速增长,1975—2016年间增长了近3倍。根据世界卫生组织发布的数据,截至2016年,全球18岁及以上成年人中约有19亿人超重,11.2亿人肥胖。肥胖可以显著增加心脏病、糖尿病、高血压、部分癌症等多种疾病的发病风险,严重影响寿命和生活质量,造成巨大的健康和经济负担。近年来,研究发现,肥胖是多种神经系统疾病如阿尔茨海默病和脑卒中的一个风险因素,这意味着肥胖对神经系统疾病的发生发展起到了关键作用。全面了解肥胖对中枢神经系统(central nervous system,CNS)的有害影响,特别是对脑血管系统的影响对预防和治疗肥胖相关的神经系统疾病至关重要。脑血管系统的一个关键组成部分是血脑屏障(blood-brain barrier,BBB),其主要位于小动脉、毛细血管和小静脉等部分。BBB严格控制血液中的分子和细胞进入脑组织,并及时地排出或降解脑组织的代谢产物或偶然进入脑组织的有害物质,对维持脑组织微环境稳态和神经细胞正常功能具有关键作用。然而,在肥胖状态下,特别是在高脂饮食(high fat diet,HFD)摄入的背景下,这一关键屏障可受到损伤,发生功能障碍,潜在导致各种神经系统疾病的发生发展。本文旨在探讨肥胖状态下BBB功能障碍的表型和潜在机制研究进展,着重阐述了BBB功能障碍在肥胖中的重要性及其对神经健康的影响,以指导未来的研究和临床实践。
1 血脑屏障的细胞和分子组成
BBB是中枢神经系统血管相对外周组织血管所具有的特殊结构,其独特功能归功于其复杂的细胞和分子组成成分,包括脑内皮细胞、周细胞、细胞外基质、星形胶质细胞,以及小胶质细胞和神经元,后者共同构成神经血管单元(neurovascular unit, NVU)。这些细胞和分子成分相互联系、相互作用,对BBB起重要的支撑作用,共同调节BBB的功能。
在结构上,脑内皮细胞紧密排列构成血管内壁,是BBB的主要组成部分。作为BBB的第一防线,脑内皮细胞具有独特的转录特征和特化的差异基因表达谱,具有能与外周内皮细胞区分开的独特属性,主要包括:(1)通过高水平的紧密连接蛋白(tight junction proteins,TJs)相连,限制细胞旁运输;(2)缺乏膜开窗(fenestration)并表现出低水平的胞吞转运(transcytosis)活性,限制跨细胞转运;(3)表达多种特定的转运蛋白,为大脑提供营养物质(如葡萄糖转运蛋白1,Glut1)和健康环境(如毒性分子外排蛋白P-糖蛋白,P-gp);(4)表达低水平的白细胞黏附分子,以限制病原体和免疫细胞入脑;(5)具有数量更多、体积更大的线粒体,为运输营养物质至大脑提供充足能量。
NVU中其他细胞对BBB的维持同样起着重要作用。具体来说,周细胞通过延长其胞体突起覆盖脑内皮细胞,从而起到调节脑血流、血管发育、紧密连接表达等作用;星形胶质细胞通过其端足包裹脑内皮细胞和周细胞,可分泌Shh(sonic hedgehog,Shh)来刺激紧密连接蛋白的表达,并降低炎症因子的表达来促进BBB的免疫静止;小胶质细胞是大脑中的常驻免疫细胞,既可参与BBB保护和神经修复过程,也可通过释放各种炎症因子损伤BBB,发挥双重作用;神经元与NVU中的其他细胞如内皮细胞、周细胞和星形胶质细胞相接触、交流,以调节BBB的特性,并构成神经血管耦合效应的基础功能单元。此外,非细胞成分细胞外基质通过为NVU中的细胞提供结构支撑、介导细胞内或间的信号通路等,也在BBB的维持中发挥重要作用。
2 肥胖引起的血脑屏障通透性改变:
表型和机制
鉴于肥胖与各种神经系统疾病之间的关系,肥胖对BBB完整性的影响是一个日益受到关注的研究领域。BBB完整性的破坏或通常所提及的“BBB渗漏”,是在肥胖状态下特别是HFD摄入背景下所观察到的常见表型,是由多种因素相互作用形成的复杂病理状态。
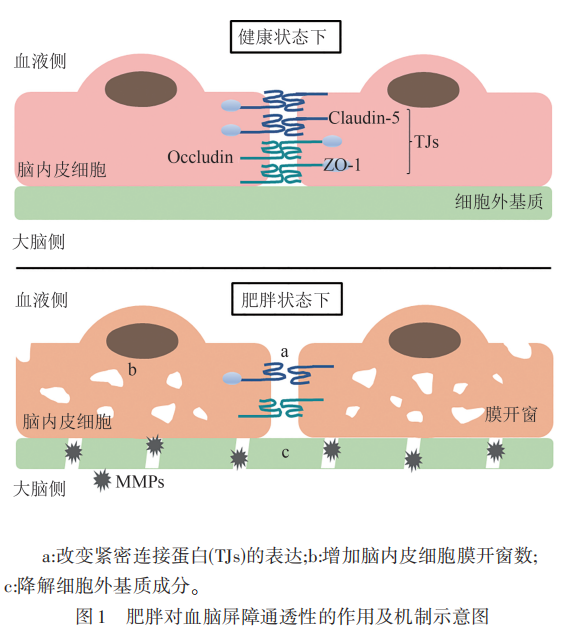
肥胖引起的BBB渗漏的一个关键因素是紧密连接蛋白的失调。如前所述,紧密连接蛋白对于维持BBB的完整性至关重要,然而在肥胖状态下,这些蛋白的表达和功能被改变。例如,经8周的HFD喂养,小鼠脑微血管紧密连接蛋白ZO-1、Claudin-5和Occludin的蛋白水平显著下降,并在氨苯砜治疗下得到有效改善。为时3个月的高脂高糖饮食则降低了大鼠脉络丛和BBB紧密连接蛋白的mRNA水平,尤其是Claudin-5。因此,在这些大鼠的海马体中观察到荧光素钠的渗透性增加,但在纹状体或前额叶皮质中则没有差异。值得注意的是,肥胖不仅对自身的BBB有影响,还会对后代产生影响。研究证明母鼠妊娠期肥胖会损害胎儿BBB的形成,使得子代大脑弓状核区域的紧密连接成分改变,BBB渗透性显著增加。紧密连接蛋白的失调损坏了BBB的完整性,导致BBB渗漏,使潜在有害物质得以从血液中进入CNS。最近的研究也将长时间摄入HFD与神经行为变化联系起来,这些神经行为恶化也伴随着紧密连接的表达异常。24周的HFD会导致焦虑样行为和抑郁样行为的增加,这可能与肠道微生物群稳态受损和炎症有关,长期的HFD可能通过肠-脑轴诱发与神经疾病相关的行为表型。与此相符的是,用抗炎分子棕榈酰乙醇胺治疗可以有效改善肥胖小鼠的焦虑样行为,同时抑制外周和中枢炎症。肥胖不仅会破坏紧密连接蛋白的表达和BBB的完整性,而且还可能引发神经行为的改变,从而继发影响BBB功能,因此需要更深入的研究来阐明肥胖、BBB功能和神经行为之间复杂的相互作用。
在正常情况下,脑内皮细胞缺乏膜开窗,限制分子跨细胞运输,有助于BBB完整性地维持。膜开窗数量的异常增加会增强BBB的通透性。因此,研究肥胖期间脑内皮细胞膜开窗的数量变化将能进一步了解BBB渗漏的表型和机制。与此相一致的是,一项研究表明肥胖会导致脑内皮细胞的膜开窗增加。在该研究中,母鼠在妊娠期持续摄入HFD,导致其后代下丘脑弓状核的内皮细胞膜开窗率和血管通透性均显著高于对照组。此外,质膜囊泡相关蛋白(PV-1)已被发现是内皮细胞开窗隔膜中的主要成分,其调节可能会影响开窗数。虽然肥胖与PV-1之间的直接联系还尚不明确,但上述研究提供了肥胖诱导开窗数增加的初步证据。以PV-1为靶点探索开窗改变的信号通路和调控机制将为肥胖如何引起BBB渗漏提供进一步的见解。
基质金属蛋白酶(matrix metalloproteinases,MMPs)是一种蛋白水解酶,其过量表达和激活会诱发细胞外基质的病理性降解以及组织结构和功能的损伤,如MMP-2和MMP-9对BBB的破坏。而肥胖与某些MMPs的表达和活性增加有关,这可能是肥胖引起BBB渗漏的机制之一。例如,肥胖受试者的MMP-9水平升高。此外,脂质运载蛋白-2(Lipocalin-2)在肥胖者的脂肪组织中也增加,并与MMP-2和MMP-9的活性相关。这些结果表明,肥胖会上调部分MMPs,这可能是由Lipocalin-2等介质的增加所驱动的。通过降解细胞外基质,这些MMPs可以破坏BBB的结构完整性。靶向这些MMPs及其调控途径可能为保护肥胖引起BBB渗漏提供治疗策略(见图1)。
3 肥胖引起的血脑屏障转运功能障碍:
表型和机制
除了造成BBB渗漏外,肥胖还与BBB转运功能的改变有关,包括瘦素(leptin)和胰岛素(insulin)等分子的运输异常、Glut1和P-gp等转运体的功能失调等。这些转运功能的改变不仅会影响大脑的营养供应,还会影响信号传导和毒素清除等过程,使得大脑处于危险情况中。
3.1 瘦素(leptin)
瘦素是一种脂肪因子,需穿过BBB作用于下丘脑,才能发挥出调节食物摄入和能量消耗的重要作用。研究发现,肥胖小鼠对通过脑室内注射的瘦素有反应,却对通过皮下或腹腔注射的瘦素没有反应,表明肥胖可导致瘦素的BBB运输功能受损,外周血液中的瘦素无法被正常运转至大脑。与此相一致的是,肥胖人群瘦素向大脑的运输水平也被下调,表现为脑脊液/血清的瘦素比值远低于健康瘦者。总之,肥胖可抑制瘦素向大脑的运输,使大脑无法接收到瘦素发出的“饱腹信号”,于是造成过度进食,进一步加重肥胖并可能引发一系列代谢疾病。此外,有研究指出循环甘油三酯以浓度依赖式方式抑制瘦素的BBB转运,而肥胖常伴随着较高水平的甘油三酯,对甘油三酯的循环水平进行干预,或许能有效治疗肥胖相关的BBB瘦素运输功能失调。
3.2 胰岛素(insulin)
胰岛素是CNS重要的负反馈调节信号,对大脑的代谢健康有重要影响。循环胰岛素以饱和运输的方式通过BBB进入大脑。研究指出,在动物模型中,肥胖降低了胰岛素向大脑的运输速率;高脂饮食会损害脑内皮细胞对胰岛素的摄取能力。在人类临床试验中,与健康瘦者相比,肥胖受试者脑脊液的胰岛素水平降低。总的来说,这些研究表明,肥胖会减少胰岛素向大脑的输送,使得胰岛素在大脑中的生理作用受损,引发大脑胰岛素抵抗。值得注意的是,大脑胰岛素抵抗是常见神经系统疾病阿尔茨海默病的早期特征。此外,与瘦素相似,有研究发现甘油三酯可穿过BBB,诱导大脑胰岛素受体抵抗,这提示靶向外周血液中的甘油三酯水平同样可能是治疗肥胖相关的BBB胰岛素运输失调的一种治疗策略。
3.3 葡萄糖转运蛋白1(Glut1)
Glut1在脑内皮细胞中高度表达,是负责将葡萄糖从血液运输至大脑以供应能量的主要转运体。在HFD摄入背景下,Glut1的表达和功能被改变。具体来说,短期急性HFD摄入会抑制大脑中Glut1的表达和葡萄糖摄取,但随着HFD摄入的时间延长,Glut1的表达被恢复,与血管内皮生长因子(VEGF)的代偿机制启动相关。相似地,小鼠胰岛素抵抗模型显示,当2周的HFD显著下调脑血管Glut1的表达时,10周HFD却能使Glut1的表达正常化,提示胰岛素抵抗的持续时间会影响对Glut1的调控。综上所述,虽然短期HFD导致的Glut1功能失调可能会被长期HFD引发的代偿机制所改善,但大脑是一个时刻需要高能量维持运转的器官,葡萄糖供能的暂时中断可能足以影响神经元的健康,对大脑构成潜在危害。
3.4 P-糖蛋白(P-gp)
P-gp是一种ATP依赖性的蛋白转运体,表达于脑内皮细胞。P-gp负责将物质从大脑运返至血液中,以保护大脑免受暴露于堆积的代谢废物和神经毒性物质之中所造成的伤害。P-gp由ABCB1基因编码,研究发现,身体质量指数(BMI)值与大脑中ABCB1表达水平呈负相关,表明肥胖患者的P-gp水平降低。虽然将肥胖与P-gp调节联系起来的机制仍有待阐明,但全身性炎症似乎起到了一定的作用。在肥胖妊娠小鼠中,胎盘P-gp的表达随着炎症因子如肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)的增加而降低。虽然关于肥胖与P-gp的研究较少,但目前的证据表明肥胖可抑制P-gp的表达,进行深入研究探索肥胖中介导P-gp表达下调的信号通路,将有助于制定恢复肥胖中BBB运输功能的治疗策略(见图2)。

4 肥胖引起的神经炎症:表型和机制
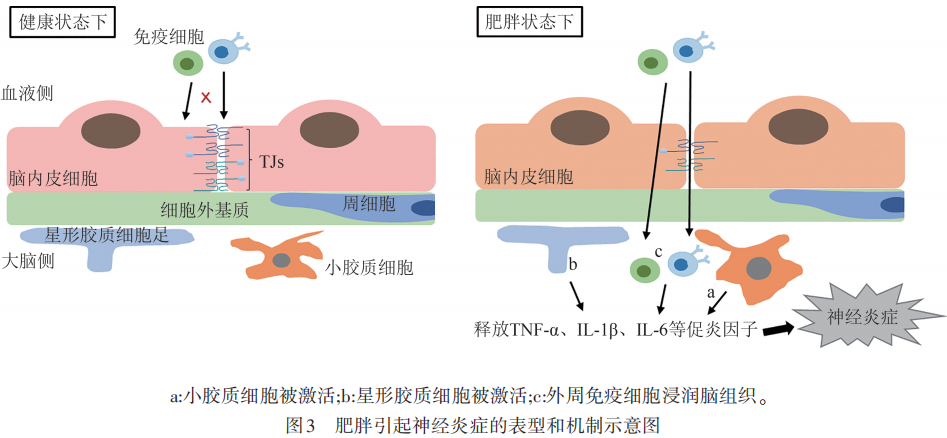
如前所述,肥胖会引起BBB通透性的增加,使得血液中的有害物质和免疫细胞得以入脑,导致常驻免疫细胞小胶质细胞的激活和外周免疫细胞的浸润,从而引发广泛的神经炎症,加快各种神经系统疾病的发生发展。近年来,神经炎症已被普遍认为是肥胖的一个重要病理特征。
小胶质细胞是大脑中的主要常驻免疫细胞,当受到病理性因素刺激时,小胶质细胞被激活并获得相应的免疫功能。不少研究表明,肥胖或HFD会增加小鼠海马体或下丘脑区域小胶质细胞的激活,促进小胶质细胞释放大量的促炎因子,如TNF-α、IL-1β和IL-6等,造成脑内的促炎环境。值得注意的是,有研究表明虽然小胶质细胞在高脂饮食诱导的早期肥胖阶段表现出促炎表型,但随着HFD摄入时间的推移,会逐渐向抗炎表型转化。这种类型的反应似乎是小胶质细胞对慢性疾病或慢性损伤的典型反应,这也意味着高脂饮食诱导的肥胖给CNS和小胶质细胞之间的稳态带来了慢性挑战。
星形胶质细胞是CNS中的另一种关键细胞类型,肥胖或HFD会刺激反应性星形胶质细胞的增生。与小胶质细胞类似,活化的星形胶质细胞也可以分泌TNF-α、IL-1β和IL-6等促炎因子,造成神经炎症。而抑制星形胶质细胞IKKβ/NF-κB信号可减轻HFD诱导的体重增加、葡萄糖耐受不良和下丘脑炎症,这表明IKKβ/NF-κB信号通路对肥胖相关的星形胶质细胞活化过程至关重要。进一步鉴定反应性星形胶质细胞内改变的多种信号通路,如IKKβ/NF-κB信号,可以促进新治疗靶点的鉴定,以减轻肥胖中与星形胶质细胞活化相关的神经炎症。
除了大脑的这两种胶质细胞,外周免疫细胞也被报道在肥胖状态下浸润CNS。一项运用骨髓嵌合小鼠模型的研究表明,与对照组相比,HFD诱导的肥胖导致CNS中的外周免疫细胞数量增加30%。这些外周免疫细胞大多数为CD45+CD11b+细胞,即表现出小胶质细胞/巨噬细胞的特征。在瘦素受体缺乏的小鼠模型中,BBB的破坏促进了外周巨噬细胞浸润肥胖小鼠的大脑。还有一项研究表明,长期摄入HFD会导致下丘脑弓状核单核细胞来源的巨噬细胞池扩大,这是由于巨噬细胞的增殖增强所致。这些研究表明,在肥胖状态下,外周免疫细胞可以被募集到CNS,并与大脑常驻免疫细胞一起参与神经炎症的发生发展(见图3)。
5 总结和展望
本文从BBB通透性改变、转运功能障碍和神经炎症3个方面,分析了肥胖背景下BBB功能障碍的具体表现和调控机制,强调了肥胖对BBB功能的有害影响。但目前尚不清楚BBB功能障碍是否为肥胖的普遍特征,或是与肥胖的程度、持续时间、年龄、性别和遗传易感性等因素有关,仍有待进一步研究。此外,肥胖引起的BBB功能障碍的潜在可逆性以及实现这种可逆性的有效策略也值得探索。更为重要的是,了解BBB功能障碍在肥胖相关神经系统疾病中的作用对未来的预防或治疗有重要的指导价值。通过更好地理解BBB功能障碍和神经系统疾病之间复杂的相互作用,我们可能会发现新的策略来减轻甚至防止肥胖对神经功能的有害影响。以BBB为靶点进行治疗干预具有巨大的潜力,不仅有望缓解肥胖引起的BBB功能障碍,而且有望减轻其下游效应,包括神经炎症和神经变性。
总之,肥胖引起的BBB功能障碍代表了一个新兴的研究领域,其潜在影响超出了肥胖领域,延伸到广泛的神经系统疾病领域。随着我们对相关机制认识和了解的不断完善,有望更深入地了解肥胖对CNS的影响,从而开发出针对BBB功能障碍来治疗肥胖相关神经系统疾病的创新治疗策略。
参考文献
[1]Risk Factor Collaboration (NCD-RisC) NCD. Worldwide trends in body-mass index,underweight,overweight,and obesity from 1975 to 2016:a pooled analysis of 2416 population-based measurement studies in 128·9 million children,adolescents,and adults[J]. Lancet,2017,390(10113):2627-2642.
[2]Flores-Cordero JA,Pérez-Pérez A,Jiménez-Cortegana C,et al. Obesity as a risk factor for dementia and Alzheimer's disease:the role of leptin[J]. Int J Mol Sci,2022,23(9):5202.
[3]Haley MJ,Lawrence CB. Obesity and stroke:can we translate from rodents to patients?[J].J Cereb Blood Flow Metab,2016,36(12):2007-2021.
[4]Profaci CP,Munji RN,Pulido RS,et al. The blood-brain barrier in health and disease:important unanswered questions[J].J Exp Med,2020,217(4):e20190062.
[5]Knox EG,Aburto MR,Clarke G,et al. The blood-brain barrier in aging and neurodegeneration[J]. Mol Psychiatry,2022,27(6):2659-2673.
[6]Schaeffer S,Iadecola C. Revisiting the neurovascular unit[J]. Nat Neurosci,2021,24(9):1198-1209.
[7]Paik DT,Tian L,Williams IM,et al. Single-cell RNA sequencing unveils unique transcriptomic signatures of organ-specific endothelial cells[J]. Circulation,2020,142(19):1848-1862.
[8]Langen UH,Ayloo S,Gu C. Development and cell biology of the blood-brain barrier[J]. Annu Rev Cell Dev Biol,2019,35:591-613.
[9]Persidsky Y,Ramirez SH,Haorah J,et al. Blood-brain barrier:structural components and function under physiologic and pathologic conditions[J]. J Neuroimmune Pharmacol,2006,1(3):223-236.
[10]郭珍妮,畅君雷. 脑血管结构与功能的生理病理及研究进展[J]. 中国科学基金,2022,36(2):270-279.
[11]Brown LS,Foster CG,Courtney JM,et al. Pericytes and neurovascular function in the healthy and diseased brain[J]. Front Cell Neurosci,2019,13:282.
[12]Alvarez JI,Dodelet-Devillers A,Kebir H,et al. The Hedgehog pathway promotes blood-brain barrier integrity and CNS immune quiescence[J]. Science,2011,334(6063):1727-1731.
[13]Ronaldson PT,Davis TP. Regulation of blood-brain barrier integrity by microglia in health and disease:a therapeutic opportunity[J]. J Cereb Blood Flow Metab,2020,40(suppl):S6-S24.
[14]Kaplan L,Chow BW,Gu C. Neuronal regulation of the blood-brain barrier and neurovascular coupling[J]. Nat Rev Neurosci,2020,21(8):416-432.
[15]Xu L,Nirwane A,Yao Y. Basement membrane and blood-brain barrier[J]. Stroke Vasc Neurol,2019,4(2):78-82.
[16]Zhan R,Zhao M,Zhou T,et al. Dapsone protects brain microvascular integrity from high-fat diet induced LDL oxidation[J]. Cell Death Dis,2018,9(6):683.
[17]Kanoski SE,Zhang Y,Zheng W,et al. The effects of a high-energy diet on hippocampal function and blood-brain barrier integrity in the rat[J]. J Alzheimers Dis,2010,21(1):207-219.
[18]Kim DW,Glendining KA,Grattan DR,et al. Maternal obesity in the mouse compromises the blood-brain barrier in the arcuate nucleus of offspring[J]. Endocrinology,2016,157(6):2229-2242.
[19]Wu H,Zhang W,Huang M,et al. Prolonged high-fat diet consumption throughout adulthood in mice induced neurobehavioral deterioration via gut-brain axis[J]. Nutrients,2023,15(2):392.
[20]Lama A,Pirozzi C,Severi I,et al. Palmitoylethanolamide dampens neuroinflammation and anxiety-like behavior in obese mice[J]. Brain Beha Immun,2022,102:110-123.
[21]Stan RV,Kubitza M,Palade GE. PV-1 is a component of the fenestral and stomatal diaphragms in fenestrated endothelia[J]. Proc Natl Acad Sci USA,1999,96(23):13203-13207.
[22]Barr TL,Latour LL,Lee KY,et al. Blood-brain barrier disruption in humans is independently associated with increased matrix metalloproteinase-9[J]. Stroke,2010,41(3):e123-e128.
[23]Palus M,Žampachová E,Elsterová J,et al. Serum matrix metalloproteinase-9 and tissue inhibitor of metalloproteinase-1 levels in patients with tick-borne encephalitis[J]. J Infect,2014,68(2):165-169.
[24]Dal-Pizzol F,Rojas HA,dos Santos EM,et al. Matrix metalloproteinase-2 and metalloproteinase-9 activities are associated with blood-brain barrier dysfunction in an animal model of severe sepsis[J]. Mol Neurobiol,2013,48(1):62-70.
[25]Dandona P,Ghanim H,Monte SV,et al. Increase in the mediators of asthma in obesity and obesity with type 2 diabetes:reduction with weight loss[J]. Obesity,2014,22(2):356-362.
[26]Unal R,Yao-Borengasser A,Varma V,et al. Matrix metalloproteinase-9 is increased in obese subjects and decreases in response to pioglitazone[J]. J Clin Endocrinol Metab,2010,95(6):2993-3001.
[27]Catalán V,Gómez-Ambrosi J,Rodríguez A,et al. Increased adipose tissue expression of lipocalin-2 in obesity is related to inflammation and matrix metalloproteinase-2 and metalloproteinase-9 activities in humans[J]. J Mol Med,2009,87(8):803-813.
[28]Van Heek M,Compton DS,France CF,et al. Diet-induced obese mice develop peripheral,but not central,resistance to leptin[J]. J Clin Invest,1997,99(3):385-390.
[29]Halaas JL,Boozer C,Blair-West J,et al. Physiological response to long-term peripheral and central leptin infusion in lean and obese mice[J]. Proc Natl Acad Sci USA,1997,94(16):8878-8883.
[30]Banks WA,Farrell CL. Impaired transport of leptin across the blood-brain barrier in obesity is acquired and reversible[J]. Am J Physiol Endocrinol Metab,2003,285(1):E10-E15.
[31]Caro JF,Kolaczynski JW,Nyce MR,et al. Decreased cerebrospinal-fluid/serum leptin ratio in obesity:a possible mechanism for leptin resistance[J]. Lancet,1996,348(9021):159-161.
[32]Schwartz MW,Peskind E,Raskind M,et al. Cerebrospinal fluid leptin levels:relationship to plasma levels and to adiposity in humans[J]. Nat Med,1996,2(5):589-593.
[33]Banks WA,Coon AB,Robinson SM,et al. Triglycerides induce leptin resistance at the blood-brain barrier[J]. Diabetes,2004,53(5):1253-1260.
[34]Baura GD,Foster DM,Porte D,et al. Saturable transport of insulin from plasma into the central nervous system of dogs in vivo. A mechanism for regulated insulin delivery to the brain[J]. J Clin Invest,1993,92(4):1824-1830.
[35]Baskin DG,Stein LJ,Ikeda H,et al. Genetically obese zucker rats have abnormally low brain insulin content[J]. Life Sci,1985,36(7):627-633.
[36]Kaiyala KJ,Prigeon RL,Kahn SE,et al. Obesity induced by a high-fat diet is associated with reduced brain insulin transport in dogs[J]. Diabetes,2000,49(9):1525-1533.
[37]Gray SM,Aylor KW,Barrett EJ. Unravelling the regulation of insulin transport across the brain endothelial cell[J]. Diabetologia,2017,60(8):1512-1521.
[38]Kern W,Benedict C,Schultes B,et al. Low cerebrospinal fluid insulin levels in obese humans[J]. Diabetologia,2006,49(11):2790-2792.
[39]Talbot K,Wang HY,Kazi H,et al. Demonstrated brain insulin resistance in Alzheimer's disease patients is associated with IGF-1 resistance,IRS-1 dysregulation,and cognitive decline[J]. J Clin Invest,2012,122(4):1316-1338.
[40]Banks WA,Farr SA,Salameh TS,et al. Triglycerides cross the blood-brain barrier and induce central leptin and insulin receptor resistance[J]. Int J Obes (Lond),2018,42(3):391-397.
[41]Haley MJ,Krishnan S,Burrows D,et al. Acute high-fat feeding leads to disruptions in glucose homeostasis and worsens stroke outcome[J]. J Cereb Blood Flow Metab,2019,39(6):1026-1037.
[42]Jais A,Solas M,Backes H,et al. Myeloid-cell-derived VEGF maintains brain glucose uptake and limits cognitive impairment in obesity[J]. Cell,2016,165(4):882-895.
[43]Ogata S,Ito S,Masuda T,et al. Changes of blood-brain barrier and brain parenchymal protein expression levels of mice under different insulin-resistance conditions induced by high-fat diet[J]. Pharm Res,2019,36(10):141.
[44]Vendelbo J,Olesen RH,Lauridsen JK,et al. Increasing BMI is associated with reduced expression of P-glycoprotein (ABCB1 gene) in the human brain with a stronger association in African Americans than Caucasians[J].Pharmacogenomics J,2018,18(1):121-126.
[45]Wang C,Li H,Luo C,et al. The effect of maternal obesity on the expression and functionality of placental P-glycoprotein:implications in the individualized transplacental digoxin treatment for fetal heart failure[J]. Placenta,2015,36(10):1138-1147.
[46]Nerurkar PV,Johns LM,Buesa LM,et al. Momordica charantia (bitter melon) attenuates high-fat diet-associated oxidative stress and neuroinflammation[J]. J Neuroinflammation,2011,8:64.
[47]Yi CX,Tschöp MH,Woods SC,et al. High-fat-diet exposure induces IgG accumulation in hypothalamic microglia[J]. Dis Model Mech,2012,5(5):686-690.
[48]Baufeld C,Osterloh A,Prokop S,et al. High-fat diet-induced brain region-specific phenotypic spectrum of CNS resident microglia[J]. Acta Neuropathol,2016,132(3):361-375.
[49]Pfuhlmann K,Schriever SC,Legutko B,et al. Calcineurin a beta deficiency ameliorates HFD-induced hypothalamic astrocytosis in mice[J]. J Neuroinflammation,2018,15(1):35.
[50]Douglass JD,Dorfman MD,Fasnacht R,et al. Astrocyte IKKβ/NF-κB signaling is required for diet-induced obesity and hypothalamic inflammation[J]. Mol Metab,2017,6(4):366-373.
[51]Buckman LB,Hasty AH,Flaherty DK,et al. Obesity induced by a high-fat diet is associated with increased immune cell entry into the central nervous system[J]. Brain Behav Immun,2014,35:33-42.
[52]Stranahan AM,Hao S,Dey A,et al. Blood-brain barrier breakdown promotes macrophage infiltration and cognitive impairment in leptin receptor-deficient mice[J]. J Cereb Blood Flow Metab,2016,36(12):2108-2121.
[53]Lee CH,Kim HJ,Lee YS,et al. Hypothalamic macrophage inducible nitric oxide synthase mediates obesity-associated hypothalamic inflammation[J]. Cell Rep,2018,25(4):934-946.
作者信息
项目基金:国家自然科学基金项目(32170985);深圳市基础研究重点项目(JCYJ20210324115800003)
作者单位:1.中国科学院深圳先进技术研究院生物医药与技术研究所,广东 深圳 518055;2.中国科学院大学深圳先进技术学院,广东 深圳 518055
通信作者:畅君雷,E-mail:jl.chang@siat.ac.cn
引证本文
冯梓莹,方程,畅君雷.肥胖引起血脑屏障功能障碍的表型和机制的研究进展[J].中风与神经疾病杂志,2024,41(1):18-23.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#肥胖# #血脑屏障功能障碍#
24