【Leukemia】安刚/邱录贵团队首次提出多发性骨髓瘤1q扩增动态演变新理论
2024-04-15 聊聊血液 聊聊血液 发表于陕西省
作者基于中国第一个前瞻纵向血液病队列,通过比较伴不同克隆大小1q扩增患者的生存、细胞遗传学事件,并对小克隆1q扩增进行分析,首次提出多发性骨髓瘤的1q扩增动态演变理论。
1q扩增动态演变
越来越多的证据表明,在多发性骨髓瘤 (MM) 疾病进展期间,1q染色体的获得或扩增 [gain/amp(1q),简称1q扩增]可发生累积。先前的研究表明,诊断时存在的1q扩增亚克隆可在 MM 复发时演变为优势克隆。但1q扩增的小克隆对 MM 生存期的影响,以及1q扩增的不同克隆大小与 MM 染色体不稳定(chromosomal instability,CIN) 之间的相关性仍知之甚少。
2014年,中国医学科学院血液病医院(中国医学科学院血液学研究所)安刚教授在《Haematologica》发文,在国际上首次探讨1q拷贝数在MM中的预后价值[1]。2022年,安刚教授在《Blood Advances》发文,在国际上首次探讨1q扩增克隆大小和拷贝数变化的预后价值[2]。近年来,多项基因组测序研究发现,1q扩增是一种发生在MM疾病发生发展较早期阶段的细胞遗传学异常[3]。此外,1q扩增被认为是MM染色体不稳定的促进因素,介导其他MM高危细胞遗传学事件的发生[4]。因此,利用大队列临床数据来分析1q扩增克隆变化和其他遗传学事件发生的规律,有助于研究1q扩增的动态演变规律和1q扩增同MM染色体不稳定间的相互作用。
安刚/邱录贵团队近日在《Leukemia》在线发表文章,作者基于中国第一个前瞻纵向血液病队列(NICHE队列),通过比较伴不同克隆大小1q扩增患者的生存、细胞遗传学事件,并对小克隆1q扩增进行分析,首次提出多发性骨髓瘤的1q扩增动态演变理论[5]。

研究结果
该研究纳入NICHE队列的MM数据库中符合IMWG共识定义的MM患者,且均具有所需的FISH数据,包括gain/amp (1q)、del(1p)、del(17p)、del(13q)和IgH易位。共纳入998例新诊断MM(NDMM)患者。
不同克隆大小的1q扩增对NDMM的预后意义
整个队列998例NDMM患者的中位随访时间为38.2个月。所有患者的基线特征详见表1。中位年龄为60岁,ISS III期和R-ISS III期患者分别占48.7%和23.2%。分别有47.8%、6.5%和5.1%的患者携带Del(13q)、Del(17p)和Del(1p),超过半数患者在诊断时携带IgH易位(578/998,57.9%)(表1)。
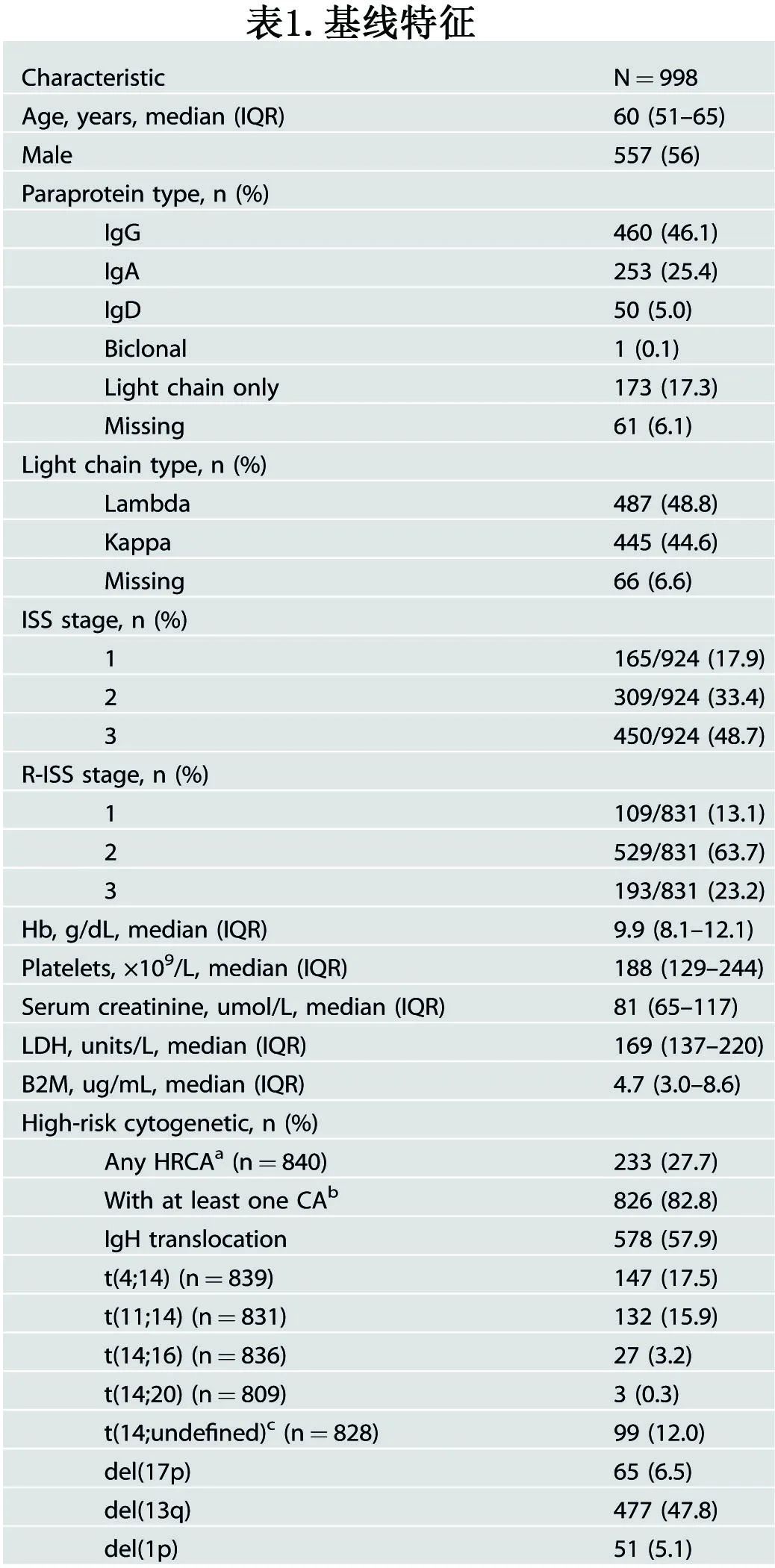
由于不同中心的1q扩增临界值也不同,因此未给1q扩增设定特定临界值,以研究1q扩增在不同克隆大小下的预后意义。513例患者在诊断时检测到1q扩增。此外,1q扩增患者的PFS和OS明显短于无1q扩增患者(PFS: 29.5个月vs. 41.9个月,HR=1.58,P<0.001;OS: 50.4个月vs. 71.0个月,HR=1.67,P<0.001)(图1A、D)。
根据1q克隆大小,将1q扩增患者分为4组:无1q扩增、1q扩增≤20%、1q扩增 20%-50%、1q扩增> 50%,其中位PFS分别为41.9个月、52.2个月、32.5个月和26.8个月,而中位OS分别为71.0个月、71.6个月、52.9个月和46.5个月(图1B、E)。1q扩增≤20%的患者与没有1q扩增的患者生存期相似,而1q扩增 20-50%和>50%的患者生存期相似。进一步的研究表明,1q扩增≤20%的患者比1q扩增>20%的患者生存率显著提高。因此,根据生存曲线,选择20%作为临界值,将患者分为无1q扩增、1q扩增≤20%和1q扩增> 20%三个亚组,其中1q扩增>20%的患者中位PFS为28.9个月,中位OS为49.4个月(图1C, F)。
与既往研究一致,该研究也可表明,获得一个以上的1q拷贝并未赋予1q扩增额外的预后意义,携带3个拷贝和携带≥4个拷贝1q的患者的中位PFS和中位OS无显著差异(PFS: 29.6个月vs 29.5个月,P=0.640;OS: 50.4个月vs 50.0个月,P=0.963)。但对于1q扩增≤20%的患者,携带≥4个1q拷贝相较于携带3个1q拷贝的PFS显著缩短(56.7个月vs. 19.8个月,P=0.029),然而OS无显著差异。对于1q扩增20%-50%或>50%的患者,携带≥4个拷贝1q的患者与3个拷贝的患者也表现出相当的PFS和OS。此外,在1q扩增患者中,不同克隆大小和拷贝数在PFS和OS方面均无统计学差异。
1q扩增的拷贝数和克隆大小演变及其与CIN表型的关系
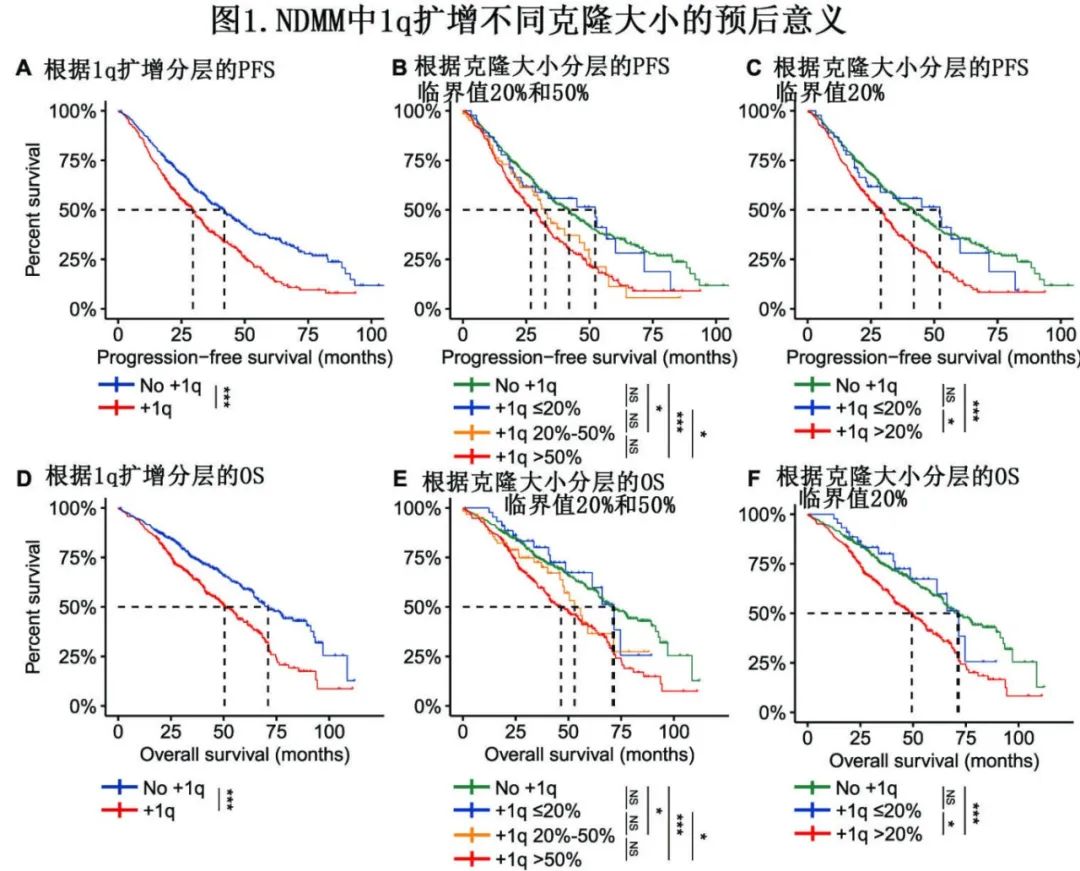
为进一步了解克隆大小和1q扩增拷贝数的特征及其关系,根据1q拷贝数将患者分为三类:3个拷贝、4个拷贝和≥5个拷贝,其1q扩增的中位克隆大小分别为71%、78%和83.5%。值得注意的是,与具有3个拷贝1q的患者相比,具有≥5个拷贝1q或4个拷贝1q的患者克隆大小明显更高(图2A)。随后使用20%和50%的临界值将1q扩增的克隆大小分为小克隆1q扩增(minor,≤20%,n=55)、中等克隆(subclonal,20-50%,n=76)和大克隆(dominant,>50%,n=382) (图2B)。
患者接受的治疗方案类似。对于无1q扩增、小克隆、中等克隆和大克隆的患者,分别有75%、81%、82%和73%的患者接受含蛋白酶体抑制剂方案(P=0.173),此外接受一线自体造血干细胞移植的比例也无显著差异(34%、26%、42%、34%,P=0.416)。
有趣的是,小克隆患者与大克隆或中等克隆患者之间的拷贝数结构相似(图2C)。进一步的分析显示,从无1q扩增到小克隆、中等克隆和大克隆患者,检测到的细胞遗传学异常(CA)数量逐渐增加,分别有65%、73%、83%和88%的患者检测到至少一种CA(图2D);其中携带至少一个高危CA的比例分别为18%、22%、27%和43% (图2E)。
del(17p)是一种诊断时较为罕见的高危细胞遗传学事件,但在大克隆患者比例更高。与只有1q扩增的患者相比,同时存在1q扩增和del(17p)的患者的1q拷贝数略高。此外对于标危CA,如del(13q)和del(1p),大克隆或中等克隆与小克隆或无1q扩增相比,其中del(13q) 和del(1p)的发生率均较高[del(13q):大克隆62%,中等克隆46%,小克隆,40%,无1q扩增38%;del(1p):8%、8%、5%、3%)](图2F)。
此外,在伴del(13q)和1q扩增的患者中,其克隆大小具有显著相关性(R=0.44,P<0.001)(图2G),在del(1p)和1q扩增患者中也观察到类似的相关性(R=0.53, P<0.001)(图2H)。最后,关于ISS分期等临床特征,大克隆或中等克隆患者中ISS III期比例高于小克隆或无1q扩增患者。综上所述,1q扩增克隆大小与其他继发性CA的增加之间存在关联,表明1q扩增与MM的CIN表型有关。
del(1p)伴小克隆1q扩增与MM的不良结局相关
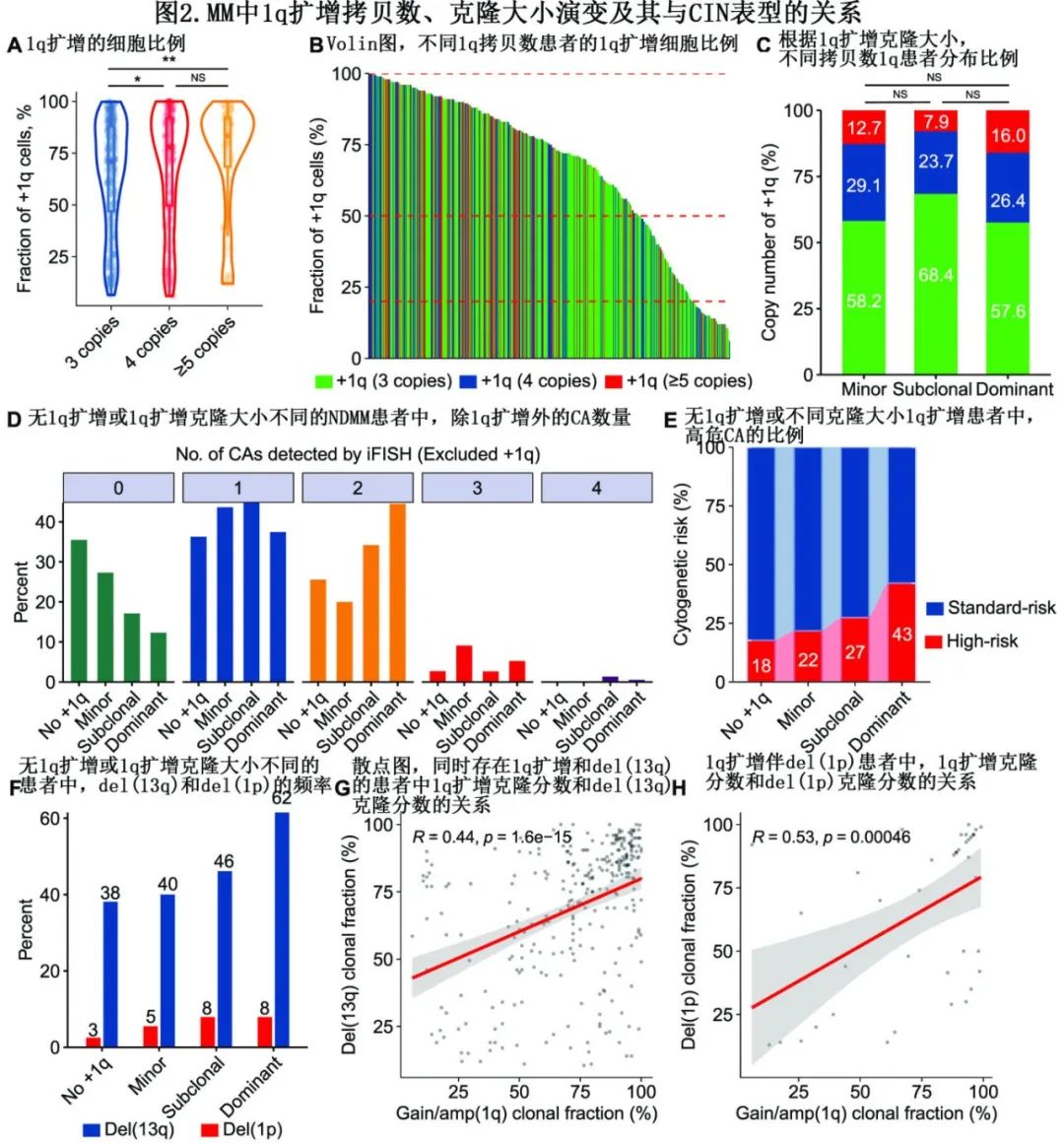
既往研究证明,1q的跳跃易位不仅可导致 1q扩增,还可导致 MM 发生其他继发性CA,包括 MYC 易位和del(16q)。因此作者假设,可能某个亚群患者具有1q扩增的小克隆,由于伴随高危遗传因素而生存率较差。因此作者最初比较了两类患者的生存结局:同时具有小克隆1q扩增和≥2种CA(1q扩增除外)vs小克隆伴<2种CA。尽管两组的 PFS 相似(+1q≤20%& <2种CA:52.9个月vs. +1q≤20%&≥2种CA:33.7个月,P=0.370)(图3A),但后者的 OS 明显更短(71.6个月vs. 40.6个月,P=0.035)(图3B)。
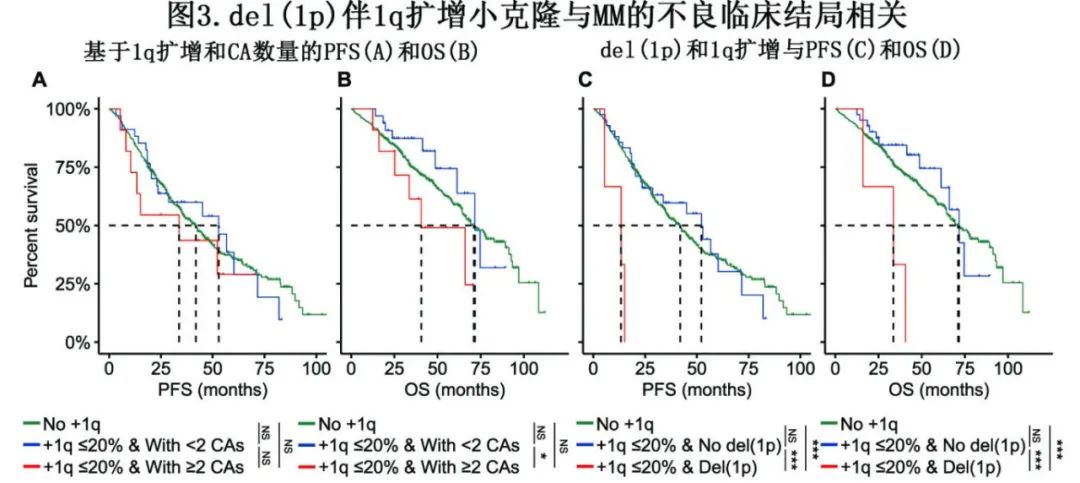
进一步分析显示, del(1p)伴小克隆1q扩增患者的PFS和OS明显短于1q扩增伴无del(1p)的患者(PFS: +1q≤20%&无del(1p): 52.2个月vs +1q≤20% & del(1p): 13.4个月,P<0.001;OS: 71.6个月vs 33.6个月,P<0.001)(图3C, D)。该结果表明,尽管1q扩增的小克隆与MM预后不良没有内在关联,但小克隆1q扩增患者共存两种以上的CA可能导致该组患者预后不良。
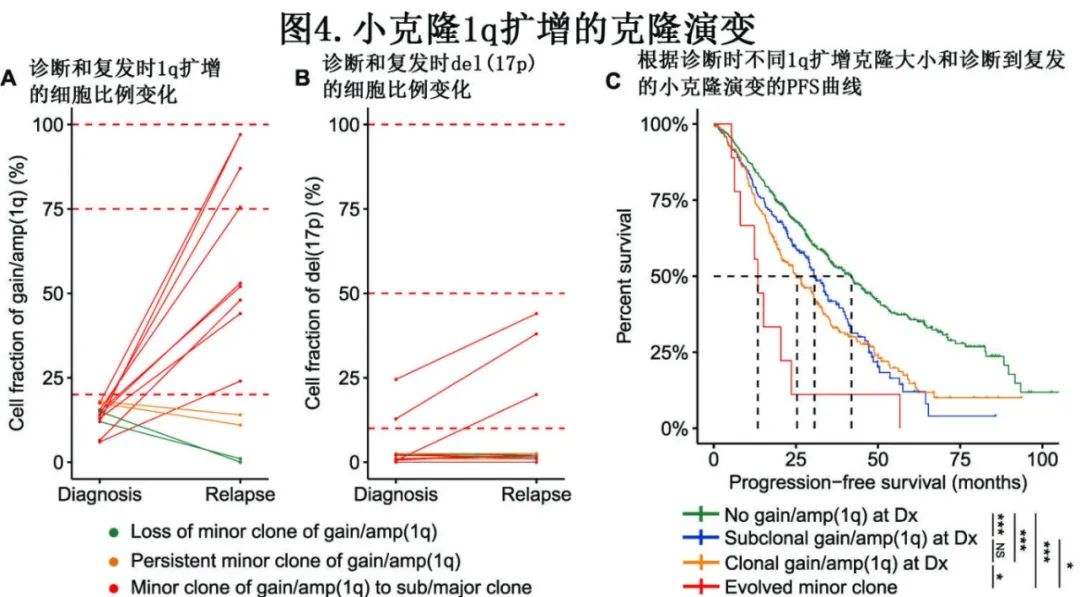
小克隆1q扩增的克隆演变
最近的研究发现,诊断时1q扩增的可克隆可成为 MM 复发时的主要克隆,此外复发时携带1q扩增的患者比例显著高于诊断,作者通过在诊断和复发时进行纵向 FISH 检查,深入研究了1q扩增小克隆的克隆演变。13例诊断时有小克隆1q扩增的患者在首次复发时接受了 FISH 检测,其中9例 (69%) 在首次复发时观察到小克隆演变为中等克隆/大克隆,而2例患者 (15%) 在诊断和复发时均保持小克隆,仅2例 (15%) 在复发时出现1q扩增小克隆丢失(图4A)。进一步分析发现,小克隆1q扩增的克隆演变伴随着 del(17) 的克隆大小扩增或新获得 del(17p)(图4B)。最后,1q扩增克隆大小显著增加的患者 PFS 显著短于诊断时 del(1q) 为小克隆和大克隆的患者(图4C),但 OS 未见显著差异。因此,该研究表明,1q扩增的小克隆在复发时倾向于演变为主要克隆,并且伴随新获得17p缺失的发生。
总结
该研究分析了998例NDMM患者的FISH结果,其中513例患者在诊断时检测到1q扩增,其中55例携带1q扩增的小克隆 (≤20%)。与无1q扩增的患者相比,1q扩增小克隆患者显示出相似的生存结局。进一步分析显示,具有1q扩增小克隆患者与无1q扩增的患者具有相似克隆结构。最后,1q扩增小克隆的克隆大小在复发时显著增加,且在 MM 很常见。
综上,该研究证明小克隆1q扩增是代表1q扩增更早期阶段的遗传学事件,在1q扩增的发生过程中可能存在由小克隆向大克隆演变的“两步走”事件。尽管小克隆1q扩增并不显著影响患者生存,但仍应对携带小克隆1q扩增的患者进行定期细胞遗传学监测,防止其发生动态演变,并进行早期干预。该研究文章是安刚教授团队在多发性骨髓瘤1q扩增领域发表的第三篇高水平学术论文,充分体现了在MM遗传学研究领域的扎实研究基础。
安刚教授、徐燕教授和邱录贵教授为本文共同通讯作者,崔健博士为第一作者。
参考文献
1. An G, Xu Y, Shi L, Shizhen Z, Deng S, Xie Z, et al. Chromosome 1q21 gains confer inferior outcomes in multiple myeloma treated with bortezomib but copy number variation and percentage of plasma cells involved have no additional prognostic value. Haematologica. 2014. 99(2): 353-359.
2. Yan Y, Qin X, Liu J, Fan H, Yan W, Liu L, et al. Clonal phylogeny and evolution of critical cytogenetic aberrations in multiple myeloma at single-cell level by QM-FISH. Blood Adv. 2022. 6(2): 441-451
3. Maura F, Bolli N, Angelopoulos N, Dawson KJ, Leongamornlert D, Martincorena I, et al. Genomic landscape and chronological reconstruction of driver events in multiple myeloma. Nat Commun. 2019. 10(1): 3835.
4. Sawyer JR, Tian E, Heuck CJ, Johann DJ, Epstein J, Swanson CM, et al. Evidence of an epigenetic origin for high-risk 1q21 copy number aberrations in multiple myeloma. Blood. 2015. 125(24): 3756-3759.
5.Cui, J., Liu, Y., Lv, R. et al. Fluorescence in situ hybridization reveals the evolutionary biology of minor clone of gain/amp(1q) in multiple myeloma. Leukemia (2024). https://doi.org/10.1038/s41375-024-02237-3
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#多发性骨髓瘤# #1q扩增动态演变#
10