帕博利珠单抗(Keytruda,简称K药),2014年首款获批FDA的PD-1,最早用于治疗黑色素瘤。上市近十年来,因其在血液淋巴瘤及多种实体瘤中的疗效,成为了世界范围内的肿瘤免疫治疗研究热点,ICIs联合化疗的综合疗法也为许多肿瘤晚期患者延长了生存周期。 随着免疫靶向治疗的发展,ADC(抗体偶联药物)因其在难治性癌症中的广泛疗效,成为了继免疫检查点抑制剂(ICIs)后肿瘤治疗的又一明星分子,而ICIs+ADC的强强联合,更是为晚期实体瘤患者的获益开启了新篇章。
ICIs联合ADC的发生机制?强强联合!
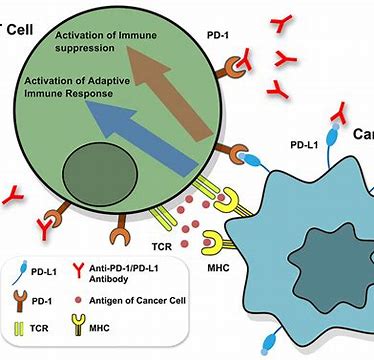
在肿瘤的免疫治疗里,活化的T细胞起到了举足轻重的作用,它们会表达抑制受体,包括细胞毒性T淋巴细胞相关蛋白4(CTLA-4),程序性死亡1(PD-1)及其配体(PD-L1),这些表达在T细胞上的起到抑制作用的蛋白,被称作免疫检查点(immune checkpoint),它的过度表达,会抑制免疫细胞的功能,使机体失去对肿瘤免疫的有效应答,最终造成肿瘤免疫逃逸,产生不良预后。
免疫检查点抑制剂(ICIs)就是针对这些T细胞上的特殊受体的特异性抗肿瘤药物,其中最被人们熟知的就是针对PD-1的K药和O药,针对PD-L1的阿替利珠单抗和度伐利尤单抗,以及针对CTLA-4靶点的伊匹木单抗,针对淋巴细胞活化基因-3(LAG-3)靶点的Relatlimab,和针对TIGHT靶点的Tiragolumab(MTIG719A)等。
ADC通过诱导T细胞浸润和增强抗原提呈,增强了ICIs的活性并导致TME中的促炎性变化。在肿瘤组织中,ADC可以大幅度扩大细胞毒素的治疗窗口,并有效减少传统全身化疗带来的毒副反应,在与ICIs的联用过程中,会触发故有免疫和获得性免疫,使T细胞增敏,提高免疫治疗药物的效果,越来越多的研究也证明了联合疗法中突出的高抗肿瘤活性。
可以说,ICIs+ADC的强强联合,具有1+1>2的效果。随着ADC耐药机制的明确,免疫疗法联合ADC成为了一个极为重要的探索方向。
ICIs联合ADC的最新进展知多少
2023年4月4日,FDA加速批准K药联合Padcev(Nectin-4 ADC,enfortumab vedotin-ejfv,简称EV)一线治疗不适合接受含顺铂化疗的局部晚期或转移性尿路上皮癌(La/mUC)。
作为首款PD-1单抗与ADC(抗体偶联药物)联合获批实体肿瘤的新疗法,Keytruda联合Padcev的客观缓解率(ORR)为68%(95% CI:58.7-76.0),完全缓解(CR)和部分缓解(PR)率分别为12%和55%。临床相关不良反应(<20%)包括呕吐(19.8%)、发热(18%)、甲状腺功能减退(11%)、肺炎(9%)、肌炎(3.3%)、重症肌无力(2.5%)、输液部位外渗(0.8%)。
2022年的ESMO BC上公布了一项DS8201-A-U105试验,研究了DS-8201联合纳武利尤单抗(O药)治疗HER2表达晚期乳腺癌患者的可行性。结果显示,HER2阳性组既往中位治疗线数为5,HER2低表达组既往中位治疗线数为4,两组ORR获益分别为65.6%和50.0%。 其中CR率分别为9.4%和0%,两个队列的中位DOR分别为未达到和5.5个月,中位PFS分别为11.6个月和7.0个月,中位OS分别为未达到和19.5个月。分析显示,无论PD-L1 IHC状态如何,HER2阳性和HER2低表达乳腺癌患者接受DS-8201联合纳武利尤单抗治疗均有效。
2023年2月24日,TROP2-ADC Trodelvy(sacituzumab govitecan-hziy,SG,戈沙妥珠单抗) 联合帕博利珠单抗,用于局部晚期或转移性三阴性乳腺癌的II期临床研究,在中国完成首例患者给药。
在2023年欧洲肺癌大会(ELCC)上,Mini Oral环节中,2期CARMEN-LC05研究报道了Tusamitamab Ravtansine(Tusa Rav)+帕博利珠单抗±化疗治疗CEACAM5阳性非鳞非小细胞肺癌(NSCLC)的疗效和安全性(摘要号13MO)。截至2023年1月10日,共25例入组患者中,在一线治疗时,所有治疗组和剂量组患者的ORR为52%,DCR为88%,16例CEACAM5≥50%的患者中,8例达到了PR,8例达到疾病稳定(SD);6例PD-L1≥50%的患者中仅有1例达到PR。在安全性方面,最常见的TEAE为恶心(44%),腹泻(36%)和乏力(32%),肺炎/间质性肺病和周围神经病变的发生率分别为16%(3级发生率为4%)和28%(均为1-2级)。
目前,虽然还需要进一步的数据支持来判断Tusa Rav+帕博利珠单抗±化疗的疗法可否用于一线治疗,但已经可以看到靶向CEACAM5新型ADC联合ICIs和化疗的更多可能。
2022 ASCO年会公布了tisotumab vedotin(TV)联合帕博利珠单抗(pembro) 一线治疗复发或转移性宫颈癌(r/mCC):ENGOT Cx8/GOG 3024/innovaTV 205的中期结果。既往没有接受过系统性治疗(不包括化疗)的复发或转移性宫颈癌患者接受推荐2期剂量(RP2D)治疗,即TV2.0 mg/kg联合帕博利珠单抗200 mg静脉注射,每3周一次。
结果表明,33例患者接受了一线TV联合帕博利珠单抗治疗(中位为6个周期)。在数据截止时(2021年7月1日),TV联合帕博利珠单抗治疗的中位时间为5.1个月(范围1-17),中位随访时间为12.2个月(范围1-17)。在32例可评估的患者中,确认的ORR为41%(95%CI为24-59),其中3例(9%)完全缓解,10例(31%)部分缓解。中位DoR未达到,7/13例患者的缓解仍在继续。中位PFS为5.3个月(95% CI 4.0-12.2);中位OS未达到。最常见的不良事件(TEAEs)包括脱发(61%)、腹泻(55%)、鼻出血(49%)、结膜炎(46%)和恶心(46%)。67%的患者出现≥3级TEAEs,最常见的是贫血(12%)、气喘(9%)、低钾血症(9%),以及丙氨酸氨基转移酶升高、白细胞计数降低、呼吸困难和急性肾损伤(各6%)。
2023年第一版宫颈癌NCCN指南里,首次将TV作为化疗期间或化疗后疾病进展的复发性或转移性的宫颈癌的二线治疗首选。
ICIs联合ADC治疗仍任重道远!
ICIs虽然经过长时间研究的成熟靶点,但是总体的影响率只有20-30%,且对于肝肾移植后凝血功能异常,患有系统性红斑狼疮、干燥综合征等自身免疫性疾病的肿瘤患者并不适用。
多项研究显示,ICIs对于高突变负荷的肿瘤效果更好,并且会有30%的患者会出现耐药导致无效。而ADC虽然已经应用在多种实体瘤中表现出高效的抗肿瘤活性,但耐药和剂量限制性毒性同样需要引起重视。二者的联合应用,给药的安全性问题应当成为重中之重。
结语
ICIs和ADC作为肿瘤治疗领域的明星分子,二者的结合,将肿瘤治疗推向了免疫靶向治疗的新篇章。在未来,随着免疫治疗的发展,CAR-T细胞疗法、溶瘤病毒、癌症疫苗等技术的成熟,免疫疗法会与ADC有着更为广泛而深入的融合。相信随着更多的试验数据结果的完善,ICIs联合ADC疗法的未来会更加光明。
参考文献:
1. N. Isambert, T. Nagy, M. Ravoire, et al. Safety and efficacy of tusamitamab ravtansine in combination with pembrolizumab ± chemotherapy in patients with CEACAM5-positive nonsquamous NSCLC (CARMEN-LC05 phase 2 study). 2023 ELCC. Abs 13MO.
2. Coleman, R. L., Lorusso, D., Gennigens, C., González-Martín, A., Randall, L., Cibula, D., Lund, B., Woelber, L., Pignata, S., Forget, F., Redondo, A., Vindeløv, S. D., Chen, M., Harris, J. R., Smith, M., Nicacio, L. V., Teng, M. S. L., Laenen, A., Rangwala, R., Manso, L., … innovaTV 204/GOG-3023/ENGOT-cx6 Collaborators (2021). Efficacy and safety of tisotumab vedotin in previously treated recurrent or metastatic cervical cancer (innovaTV 204/GOG-3023/ENGOT-cx6): a multicentre, open-label, single-arm, phase 2 study. The Lancet. Oncology, 22(5), 609–619. https://doi.org/10.1016/S1470-2045(21)00056-5
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











好文章,值得一读。
37