NEJM:ozanimod治疗溃疡性结肠炎初见成效
Ozanimod(RPC1063)是鞘氨醇-1-磷酸受体亚型1和5的口服激动剂,可诱导外周血淋巴细胞隔离,有可能减少活化的淋巴细胞循环到胃肠道的数量。原始出处:William J.Wolf,et al.Ozanimod Induction and Maintenance Treatment for Ulcerative Co
MedSci原创 - ozanimod,溃疡性结肠炎 - 2016-05-05
Lancet Gastroen Hepatol:Ozanimod用于中重度克罗恩病的治疗
Ozanimod治疗可改善中重度克罗恩病患者内窥镜检查、组织学和临床反应
MedSci原创 - 克罗恩病,CD,ozanimod - 2020-06-16
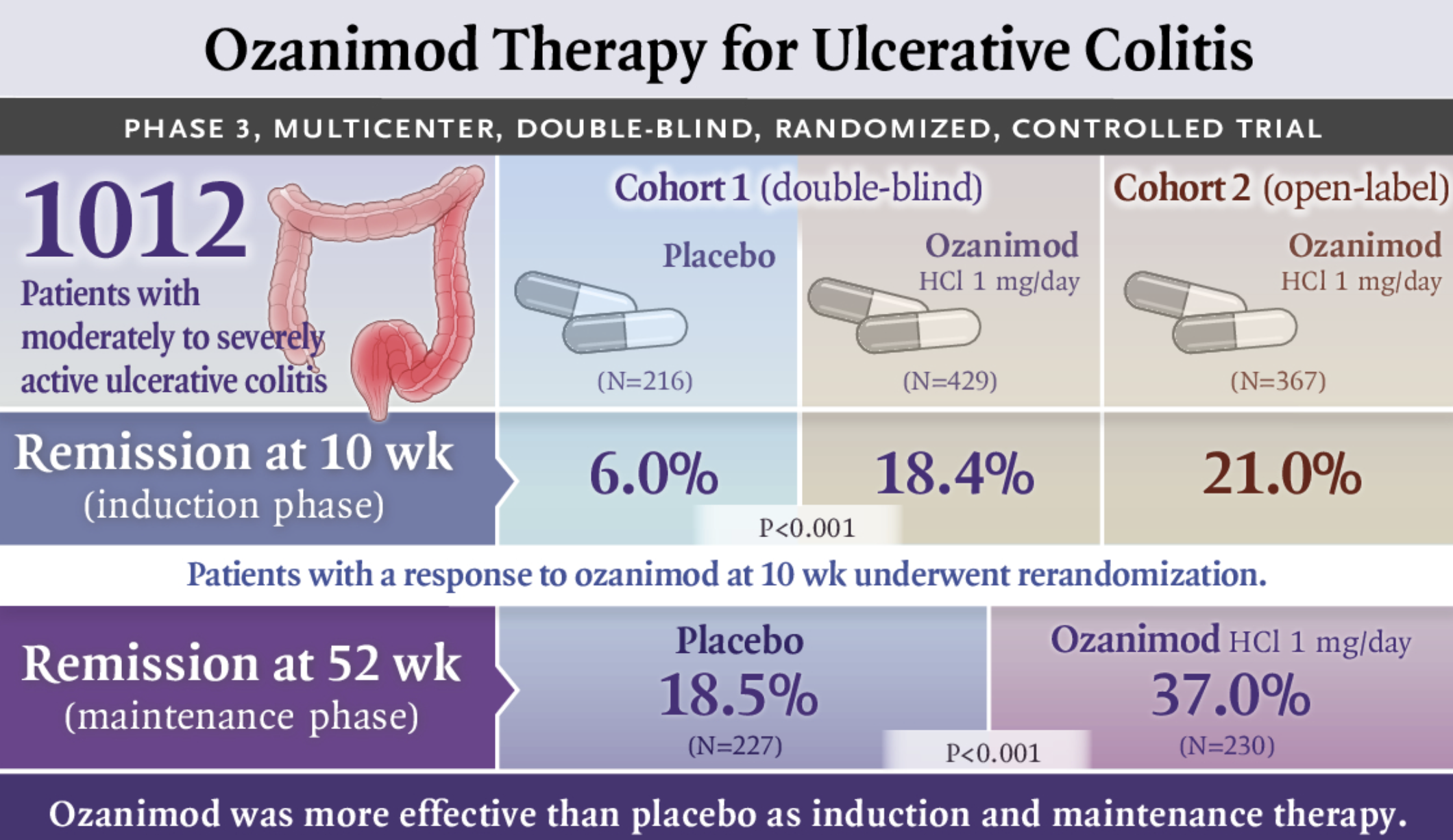
NEJM:Ozanimod作为溃疡性结肠炎的诱导和维持治疗
Ozanimod作为中度至重度活动性溃疡性结肠炎患者的诱导和维持治疗比安慰剂更有效。
MedSci原创 - 诱导,维持治疗,溃疡性结肠炎,ozanimod - 2021-09-30
FDA拒绝了Celgene旗下的Ozanimod用于多发性硬化症
Celgene周二(2018年2月27日)宣布,它已收到FDA拒绝关于该公司在治疗复发型多发性硬化症患者中使用Ozanimod的市场推广申请的信函。
MedSci原创 - ozanimod,多发性硬化症,干扰素 - 2018-02-28
欧洲药品管理局批准Zeposia(ozanimod)治疗溃疡性结肠炎
欧洲药品管理局(EMA)已批准其Zeposia(ozanimod)的销售授权申请(MAA),用于治疗中度至重度活动性溃疡性结肠炎(UC)。
MedSci原创 - 欧洲药品管理局,溃疡性结肠炎,ozanimod,Zeposia(ozanimod) - 2020-12-31
Zeposia(ozanimod)治疗中重度溃疡性结肠炎成年患者:III期研究取得突破性进展
溃疡性结肠炎(UC)是一种会导致结肠与直肠发炎与溃疡的慢性疾病。其发作时的主要症状包括腹痛、伴有血便的腹泻、体重减轻、发热以及贫血等症状。
MedSci原创 - 溃疡性结肠炎,Zeposia(ozanimod) - 2020-10-12
2019年欧洲神经病学学会EAN:Ozanimod显着减少复发多发性硬化患者的脑容量损失
第5届欧洲神经病学学会(EAN)上的最新报告,与干扰素β-1a相比,Ozanimod在复发性多发性硬化症(MS)患者中更好地减少了全脑容量、皮质灰质体积和丘脑体积的损失。
MedSci原创 - 2019年欧洲神经病学学会,ozanimod,多发性硬化症,脑容量损失 - 2019-07-07
Zeposia (ozanimod) 治疗中重度活动性溃疡性结肠炎成人患者,CHMP持积极意见
百时美施贵宝近日宣布,欧洲药品管理局 (EMA) 的人用药品委员会 (CHMP) 已建议批准Zeposia (ozanimod) 用于治疗患有中度至重度活动性溃疡性结肠炎的成人患者。
MedSci原创 - 治疗溃疡性结肠炎,Zeposia (ozanimod) - 2021-10-17
JCC:接受全结肠切除术的ozanimod暴露的溃疡性结肠炎患者表现出独特的淋巴结组织学变化
目前缺乏ozanimod对溃疡性结肠炎患者肠系膜淋巴结产生影响的数据。本研究的目的是比较全腹结肠切除术中切除的淋巴结与接受其他治疗的UC患者的淋巴结的组织病理学结果。
MedSci原创 - 溃疡性结肠炎,ozanimod,淋巴结病理 - 2023-11-07
百时美施贵宝的1-磷酸鞘氨醇受体调节剂ozanimod,获FDA批准治疗复发型多发性硬化症
Ozanimod作为每日一次的口服药物,是目前唯一获批的1-磷酸鞘氨醇受体调节剂。
MedSci原创 - 1-磷酸鞘氨醇受体,ozanimod,复发型多发性硬化症 - 2020-03-26
【盘点】溃疡性结肠炎2016年研究新进展
溃疡性结肠炎是一个局限在结肠粘膜和粘膜下层的疾病,病因尚未完全阐明,主要是侵及结肠黏膜的慢性非特异性炎性疾病,临床症状轻重不一,可有缓解与发作相交替,患者可仅有结肠症状,也可伴发全身症状。这里小编盘点下2016年关于溃疡性结肠炎的一些相关研究与大家分享。 【1】 维生素D缺乏可促进溃疡性结肠炎的发生 来自芝加哥大学医学院的一项研究表明,体外和在小鼠模型实验研究中均可发现维生素D具有
MedSci原创 - 溃疡性结肠炎 - 2016-08-10
FDA:2020年一季度批准11款新药信息汇总
2020年第一季度,FDA共批准11个新药上市,其中1月份3个,2月份5个,3月有3个(此处所列新药,主要指FDA批准的新分子实体(NME)、新生物制品、细胞疗法、基因疗法,不包括疫苗)
MedSci原创 - FDA,新药 - 2020-04-04
S1PR靶点全球及中国竞争格局分析
2019年3月26日,美国FDA批准诺华开发的西尼莫德上市,用于治疗复发型多发性硬化症成人患者的治疗,包括临床孤立综合征、复发缓解型多发性硬化症和活动性继发进展型多发性硬化症。这是美国FDA批准的第二个鞘氨醇-1-磷酸受体(Sphingosine-1-phosphate receptor,SIPR)调节剂,也是首款治疗继发进展型多发性硬化症的上市药物。小编利用药渡数据库梳理了SIPR靶点全球及国内
药渡 - S1PR靶点,诺华,市场竞争 - 2019-06-27
FDA批准S1P受体调控剂ozanimod用于多发性硬化症药物
今天FDA批准了施贵宝的多发性硬化症药物、S1P受体调控剂ozanimod(商品名ZEPOSIA),用于成人复发性MS(RRMS)患者的治疗。
MedSci原创 - FDA,多发性硬化症,ozanimod - 2020-03-28
为您找到相关结果约28个