阿斯利康9500万美元购买优先审评券,哪项研发项目可能获益?
今日,阿斯利康(AstraZeneca)宣布,以9500万美元的价格从瑞典一家公司Sobi收购了一张FDA优先审评劵。优先审评劵可将新药申请的审批时间从10个月缩短到6个月,从而大大加速新药的上市进程。
药明康德 - 阿斯利康,优先审评药物研发 - 2019-08-25
药审中心拟优先审评名单更新
4月17日,药审中心公示的拟优先审评的药品品种新增以岭万洲国际制药有限公司的非洛地平缓释片(规格为2.5mg、5mg、10mg),公示期间如有异议,可在药审中心网站“信息公开-->优先审评公示-->拟优先审评品种公示
中国药审 - 优先评审,药品注册 - 2019-04-22
抗疟疾新药获FDA优先审评资格
近日,60 Degrees Pharmaceuticals(60P)宣布,美国FDA授予其预防成人疟疾药物Tafenoquine (TQ)优先审评资格。2018年1月,该药物获得FDA的快速通道资格。
药明康德 - Tafenoquine,FDA,优先审评 - 2018-02-12
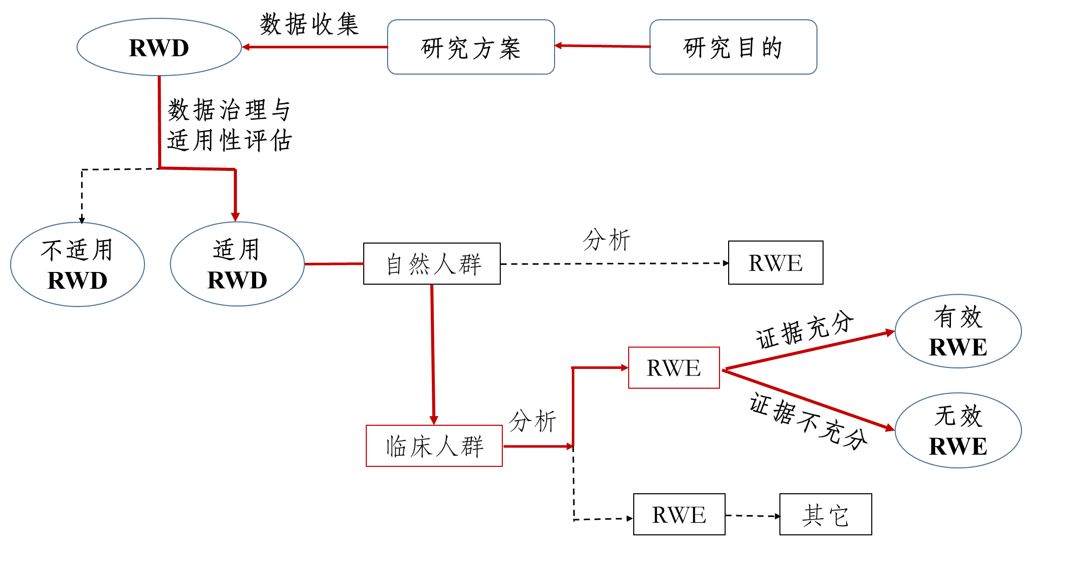
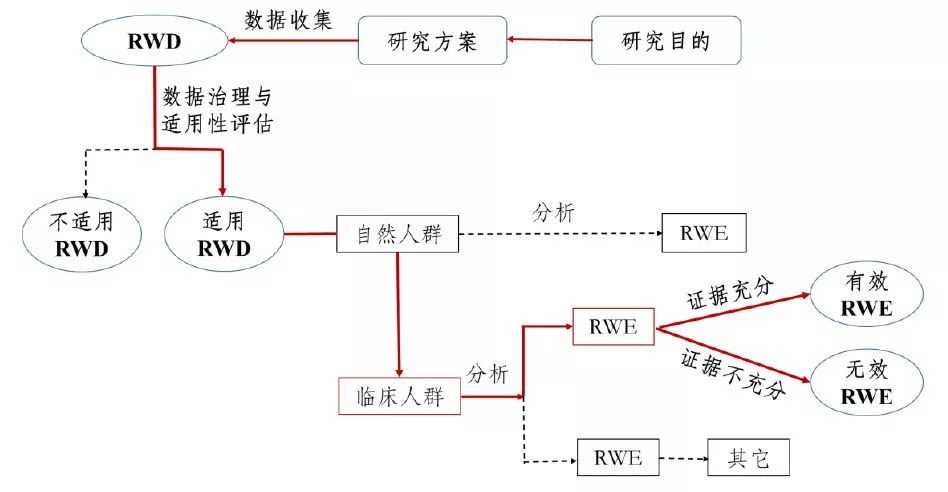
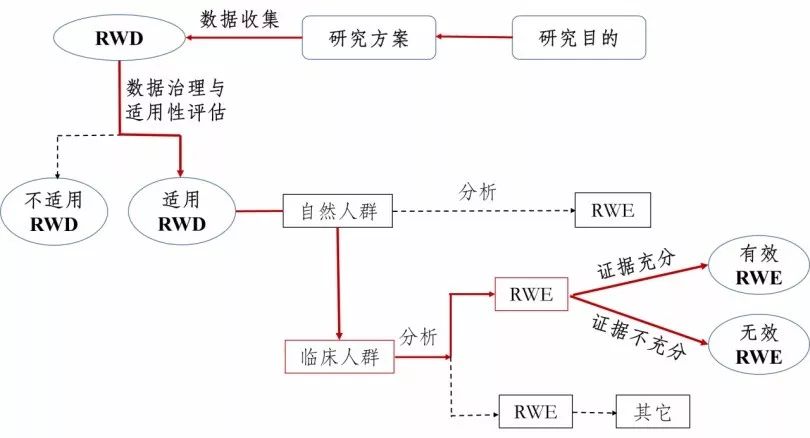
真实世界证据支持药物研发与审评的指导原则(试行)
为进一步指导和规范真实世界证据用于支持药物研发和审评的有关工作,保障药物研发工作质量和效率,国家药品监督管理局组织制定了《真实世界证据支持药物研发与审评的指导原则(试行)》,现予发布。 国务院《关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)以及中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,均提出鼓励研究和创制新药。
CDE - 真实世界,证据 - 2020-01-11
真实世界证据支持药物研发审评,这四点思考值得关注!
1月7日,国家药监局把2020年的一号文件,留给了此前就备受行业关注的真实世界证据支持药物研发与审评。 在其官网上,药监局同时公布了《真实世界证据支持药物研发与审评指导原则(试行)》,以及该文件的起草说明。作为国内发布的首个真实世界证据支持药物研发与审评的指导文件,这被视为新药研发审评道路上的里程碑事件,并迅速引起了行业的密切关注。事实上,如何利用真实世界证据评价药物的有效性和安全性
E药经理人 - 真实世界,证据 - 2020-01-11
8款药品注册申请拟纳入优先审评
2019年3月29日,药审中心公示的拟优先审评的药品品种新增“盐酸安非他酮缓释片”等,公示期间如有异议,可在药审中心网站“信息公开-->优先审评公示-->拟优先审评品种公示”栏目下提出异议。
中国药审 - 药品,优先审评 - 2019-04-01
快速缓解抑郁的口服新型药物——舒拉诺龙获FDA优先审评资格
目前,全球范围内约每8人中就有1人罹患精神疾病。其中,抑郁症是最常见的精神疾病之一,全球约2.8亿患者。与此同时,近2/3抑郁症患者无法从现有疗法中获得充分缓解。这反映出以抑郁症为代表的精神卫生问题面
MedSci原创 - 抑郁症,产后抑郁,舒拉诺龙 - 2023-02-07
优先审评审批助力丙肝新药加快上市
随着我国药品审评审批制度改革的持续推进,广大丙肝患者的热切期盼成为现实——9月21日,国家食品药品监督管理总局同时批准吉利德公司(Gilead)的口服丙肝新药索磷布韦片,艾伯维公司(AbbVie)的奥比帕利片上述药物从申报至拿到注册证,仅用7个月。
中国医药报 - 优先评审,丙肝新药,上市 - 2017-09-25
国内申报上市的第二个CAR-T疗法获“优先审评+突破性药物”双重审评资格
日前,据国家药监局药审中心最新公示,张江科学城企业药明巨诺的瑞基仑赛注射液(暂定名,研发代码为JWCAR029,通用名为“CD19靶向嵌合抗原受体T细胞”)上市申请拟被纳入优先
医谷网 - CAR-T,突破性药物,优先审批 - 2020-09-10
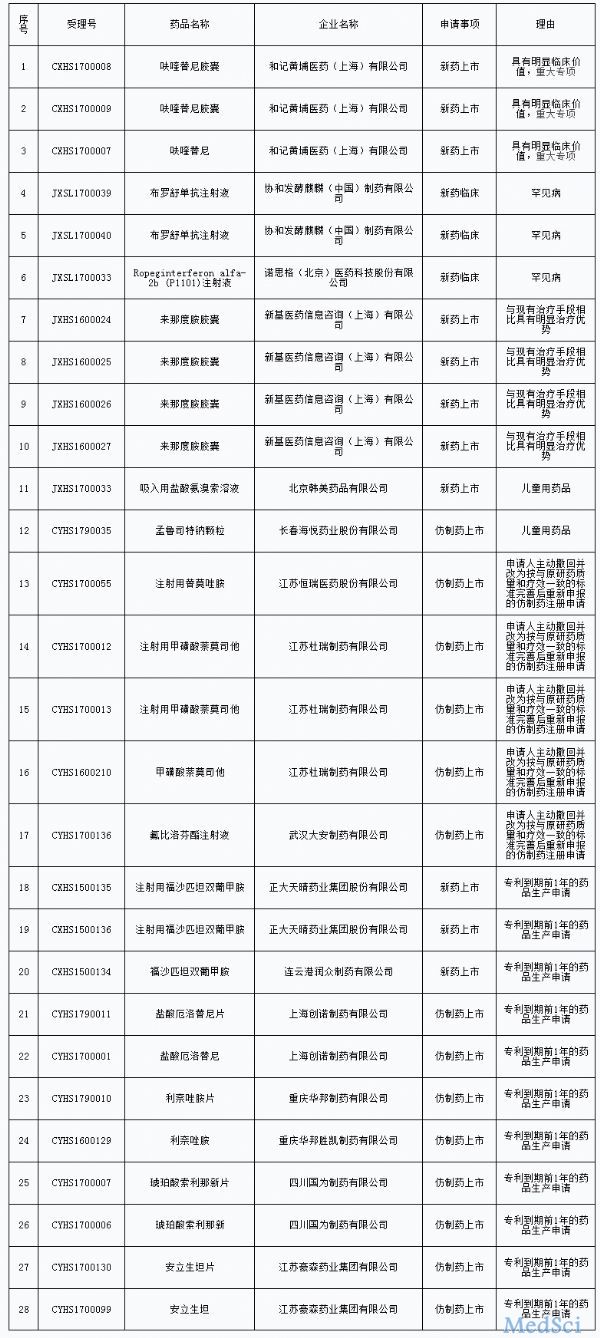
最新优先审评名单出炉,再添28个药品
今日(9月4日),国家食品药品监督管理总局药品审评中心(简称“CDE”)发布《拟纳入优先审评程序药品注册申请的公示(第二十二批)》,将拟优先审评的药品注册申请及其申请人予以公示,根据公示名单,此次入选的
医谷 - 药品,评审,药品注册申请 - 2017-09-04
CSCO2022 CDE专场|抗肿瘤ADC药物的临床研发与审评考虑
DE夏琳审评员作了题为“抗肿瘤ADC药物的临床研发与审评考虑”的报告,对ADC药物的临床研发现状进行了简要的介绍并强调了ADC药物研发过程中需要考虑的重要方面。
网络 - CDE,ADC药物,CSCO2022 - 2022-11-08
新增15个品种拟被CDE纳入优先审评程序
8月19日至22日,CDE网站拟优先审评公示栏新增15个品种。拟同意纳入优先审评的理由分别是:注射用复方维生素(13)为仿制药上市;小儿钠钾镁钙葡萄糖注射液、小儿等渗电解质注射液为儿童药;曲美替尼片、达拉非尼胶囊、HSK3486乳状注射液、西妥昔单抗注射液、帕博利珠单抗注射液为具有明显治疗优势药品;阿卡波糖片则为符合117公告品种、申请人主动撤回的优先条件。
新浪医药新闻 - 优先审评,治疗优势 - 2019-08-25
为您找到相关结果约500个