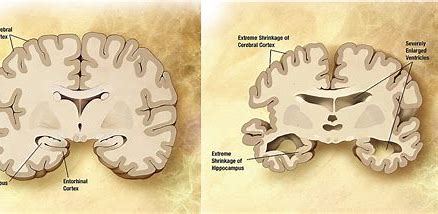
Eisai和Biogen正在向FDA申请aducanumab治疗阿尔茨海默症的优先审查
制药公司百健(Biogen)和卫材(Eisai)近日表示,FDA接受了aducanumab治疗阿尔茨海默症优先审查的申请,并将目标行动日期定为明年3月7日。
MedSci原创 - 阿尔茨海默症,早老性痴呆,aducanumab - 2020-08-09
FDA开始优先审查来那度胺与美罗华联合治疗淋巴瘤的潜力
美国食品和药物管理局FDA已开始优先审查Celgene的Revlimid来那度胺与罗氏的Rituxan美罗华联合治疗淋巴瘤的潜在价值。
MedSci原创 - 淋巴瘤,来那度胺,美罗华 - 2019-02-28
FDA批准了优先审查赛诺菲的白细胞介素-4单抗Dupixent治疗鼻窦炎
该药物获得优先审查是基于两项关键性III期试验数据的支持,这些试验评估了Dupixent与标准治疗药物皮质类固醇鼻喷雾剂联合使用时的疗效和安全性。
MedSci原创 - 白细胞介素-4单抗,Dupixent,鼻窦炎 - 2019-03-08
百时美施贵宝 Opdivo 治疗转移性结肠直肠癌获得 FDA 优先审查
4 月 5 日,百时美施贵宝公司对外宣布,美国食品和药物管理局(FDA)接受了公司旗下补充生物制剂的许可申请(sBLA)。FDA 对该药物进行了优先审查,最终的结果将于 2017
新浪医药 - 转移性结肠直肠癌,审批 - 2017-04-06
FDA将优先审查C5补体单抗Eculizumab用于治疗视神经脊髓炎NMOSD患者
Alexion Pharmaceuticals公司今天宣布,FDA接受优先审查sBLA( eculizumab),该公司的第一个C5补体抑制剂,用于治疗具有抗水通道蛋白-4(AQP4)自身抗体的神经脊髓炎视神经疾病
MedSci原创 - C5补体,神经脊髓炎,优先审查 - 2019-02-24
默克针对革兰氏阴性菌感染的抗生素组合Recarbrio,获得FDA的优先审查
美国食品和药物管理局(FDA)已开始对默克的抗生素组合药物Recarbrio进行审查,该药可为难以治疗的革兰氏阴性菌感染提供新的选择。
MedSci原创 - 默克,革兰氏阴性菌,抗生素组合,Recarbrio,FDA,优先审查 - 2020-02-04
Bayer/Orion的非甾体雄激素受体拮抗剂darolutamide治疗前列腺癌获得FDA优先审查
美国食品和药物管理局(FDA)已接受新的药物申请审查,并给予darolutamide优先审查。
MedSci原创 - 非甾体雄激素受体拮抗剂,darolutamide,前列腺癌,FDA优先审查 - 2019-05-01
FDA为Alnylam的RNAi疗法Lumasiran授予优先审查,用于治疗1型原发性高草酸尿症
Lumasiran是靶向羟基酸氧化酶1(HAO1)、可按季度皮下给药的的RNAi治疗药物。
MedSci原创 - 优先审查,1型原发性高草酸尿症(PH1),RNAi疗法Lumasiran - 2020-06-03
强生Zejula获美国FDA突破性药物资格中国大陆已进入优先审查!
强生旗下杨森制药近日宣布,美国FDA已授予PARP抑制剂类抗癌药Zejula,用于治疗先前已接受紫杉烷化疗和雄激素受体(AR)靶向药物治疗、携带BRCA1/2基因突变的转移性去势抵抗性前列腺癌(mCRPC
新浪医药 - 强生,Zejula,杨森制药 - 2019-10-09
诺华的MET抑制剂卡马替尼治疗非小细胞肺癌,获得FDA授予优先审查
诺华制药宣布,美国食品药品监督管理局(FDA)接受了MET抑制剂卡马替尼(INC280)的新药申请(NDA)并给予了优先审查,用于一线治疗和先前治疗过的局部晚期或转移性MET外显子14跳跃(METex14
MedSci原创 - 诺华,MET抑制剂,卡马替尼,非小细胞肺癌,FDA,优先审查 - 2020-02-14
靶向HER2的抗体偶联药物ADC治疗转移性乳腺癌获得FDA的优先审查
阿斯利康和第一三共公司宣布,其生产的靶向HER2的抗体药物偶联物(ADC)--[FAM-]曲妥珠单抗deruxtecan(DS-8201)治疗HER2阳性转移性乳腺癌的审查生物制剂许可申请(BLA),已被美国食品和药物管理局(FDA)接受并被授予优先审查。
MedSci原创 - 靶向HER2,抗体偶联药物,ADC,转移性乳腺癌,FDA优先审查 - 2019-10-22
百济神州的BTK抑制剂zanubrutinib治疗淋巴瘤,获得了FDA的优先审查
百济神州BeiGene的BTK抑制剂zanubrutinib获得了FDA的优先审查,明年2月可能获得批准。这是BeiGene的一个重要里程碑,也是其候选药物首次在美国申请并接受FDA审查。
MedSci原创 - 百济神州,BTK抑制剂,zanubrutinib,淋巴瘤,FDA优先审查 - 2019-08-26
美国FDA接受了Upadacitinib治疗中度至重度类风湿性关节炎的优先审查新药申请
AbbVie是一家以研究为基础的全球生物制药公司,已宣布美国食品和药品监督管理局(FDA)已接受Upadacitinib治疗中度至重度类风湿性关节炎的优先审查新药申请(NDA)。
网络 - upadacitinib,类风湿性关节炎,优先审查新药申请 - 2019-02-23
FDA授予安进BiTE免疫疗法Blincyto治疗儿科急性淋巴细胞白血病(ALL)的优先审查资格
美国生物技术巨头安进(Amgen)BiTE免疫疗法Blincyto(blinatumomab)近日在美国监管方面传来喜讯,FDA已受理Blincyto的补充生物制品许可(sBLA),同时授予优先审查资格
MedSci原创 - BiTE,免疫,Blincyto - 2016-05-04
美国FDA授予拜耳靶向抗癌药Stivarga优先审查资格,二线治疗晚期肝细胞癌
美国食品和药物管理局(FDA)已授予Stivarga补充新药申请(sNDA)优先审查资格,该sNDA寻求批准Stivarga用于不可切除性肝细胞癌(HCC)患者的二线治疗。
生物谷 - 拜耳,Stivarga,瑞戈非尼,结直肠癌 - 2017-01-05
为您找到相关结果约500个